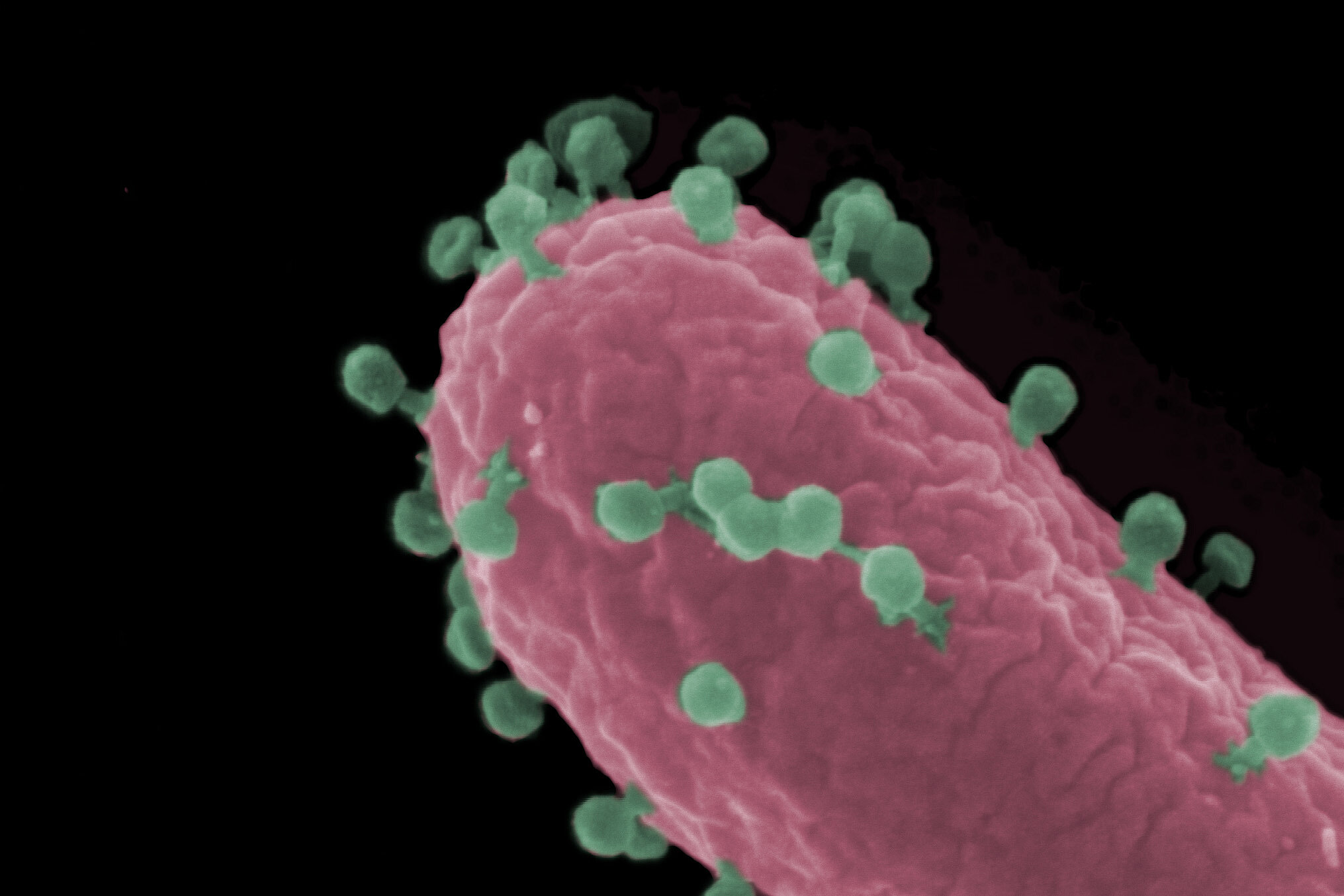
Auch Bakterien haben mit Viren zu kämpfen – mit sogenannten Bakteriophagen, kurz Phagen genannt. Sie dringen in Bakterien ein, machen sich die zelluläre Maschinerie zu eigen, vermehren sich und bringen dann die Bakterienzelle zum Bersten. So werden neue Phagen freigesetzt, die wiederum weitere Bakterien infizieren können. Für den Menschen sind Phagen ungefährlich, da sie es auf Bakterien abgesehen haben. Und dabei sind sie auch noch ziemlich wählerisch: Jeder Phage ist auf ganz bestimmte Wirtsbakterien spezialisiert, darunter auch bakterielle Krankheitserreger.
„Indem sie Krankheitserreger befallen und dezimieren, schützen Phagen ganz nebenbei unsere Gesundheit – quasi in einer Art verdeckter Operation. Ihr Potenzial therapeutisch nutzbar zu machen, insbesondere vor dem Hintergrund zunehmender Antibiotikaresistenzen, wäre ein Gamechanger“, sagt der Leiter der Studie, Jörg Vogel. Er ist Geschäftsführender Direktor des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) in Würzburg, einem Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) in Kooperation mit der Julius-Maximilians-Universität Würzburg (JMU), und leitet auch das Institut für Molekulare Infektionsbiologie (IMIB) der Medizinischen Fakultät der JMU.
Molekulares Werkzeug eingeschleust – Phage gehackt
„Um Phagen therapeutisch zu nutzen, müssen wir allerdings noch viel besser verstehen, wie das molekulare Wechselspiel zwischen Phagen und Wirtsbakterien genau funktioniert“, sagt Erstautor Milan Gerovac, ehemals Postdoc im Labor von Jörg Vogel und inzwischen Leiter der Nachwuchsgruppe „Komplexe in Phageninfizierten Zellen“ am HZI. „Bislang ist dazu noch nicht viel bekannt. Das liegt unter anderem daran, dass Phagen ihr Erbgut mit einer Art Schutzschild vor dem Phagenabwehrsystem der Bakterienzelle schützen. Und das wirkt leider auch ziemlich gut gegenüber gängigen molekularen Untersuchungsmethoden.“
Um die molekulare Phage-Wirt-Beziehung zu entschlüsseln, muss man sich also etwas Besonderes einfallen lassen – und genau das haben die Forschenden in ihrer aktuellen Studie getan: Mithilfe eines innovativen RNA-basierten molekularen Werkzeugs – sogenannten Antisense-Oligomeren (ASOs) – gelang es ihnen, in den Vermehrungszyklus von Phagen gezielt einzugreifen. „Die in die Bakterienzelle eingeschleusten ASOs haben die Phagen-Proteinsynthese an zentralen Stellen ausgeschaltet“, erklärt Gerovac. „Wir konnten uns mit den ASOs gewissermaßen in die Phagen-Entwicklung ‚einhacken‘.“
ASOs können im Labor so synthetisiert werden, dass sie passgenau an bestimmte Stellen der sogenannten Boten-Ribonukleinsäure (mRNA, von engl. messenger RNA) binden, die die Information für die Herstellung von Proteinen übertragen. Die ASOs wirken dann am Startpunkt der Proteinherstellung wie ein Hemmschuh: Die mRNA kann nicht mehr ausgelesen werden, und die Proteinsynthese kommt gar nicht erst ins Laufen. Antibakterielle ASOs, die auch als programmierbare Antibiotika oder Asobiotika bezeichnet werden, sind schon länger bekannt und werden im Labor von Vogel intensiv erforscht. „Da ASOs bekanntermaßen die Proteinsynthese von Bakterien hemmen können, vermuteten wir, dass sie dies auch bei Phagen können. Denn Phagen vermehren sich mithilfe der zellulären Maschinerie der Wirtsbakterien“, sagt Vogel. „Und damit lagen wir goldrichtig!“
Im Fokus: Ein Jumbo-Phage, der Krankenhauskeime killt
Mit der ASO-Technologie konnten die Forschenden die Phagenentwicklung in verschiedenen Phagen-Bakterien-Paaren erfolgreich unterbinden und zeigen, dass sich der Ansatz für eine breite Anwendung eignet. Im Fokus ihrer Untersuchungen stand jedoch ein sogenannter Jumbo-Phage namens ΦKZ, mit dem man perspektivisch gefährliche Infektionen von Wunden, Atemwegen und Lunge mit dem Krankenhauskeim Pseudomonas aeruginosa behandeln könnte. „Jumbo-Phagen besitzen ein ausgesprochen großes Erbgut“, erklärt Gerovac. „Mithilfe der ASOs konnten wir die Synthese unterschiedlichster Phagenproteine systematisch ausschalten und mit diesem sogenannten Knock-Down-Screening-Ansatz bisher noch unbekannte, für die Phagenentwicklung zentrale Proteine identifizieren.“
Die Wissenschaftler hoffen, dass die ASO-Technologie in der Phagenforschung breite Anwendung finden wird, um die grundlegenden molekularen Mechanismen von Phagen besser zu verstehen und die Entwicklung neuer Therapieansätze im Kampf gegen bakterielle Krankheitserreger voranzutreiben.
Text: Nicole Silbermann