Bakterien verfügen über eine Vielzahl von Mechanismen, um Eindringlinge wie etwa Viren abzuwehren. Eine dieser Strategien besteht darin, Transfer-Ribonukleinsäuren (tRNA, von engl. transfer ribonucleic acid) zu spalten. Solche tRNAs sind in sämtlichen Zellen vorhanden und spielen eine grundlegende Rolle bei der Übersetzung von Boten-RNA (mRNA, von engl. messenger RNA) in lebenswichtige Proteine. Sie zu deaktivieren, schränkt die Proteinproduktion ein, was dazu führt, dass die infizierte Zelle in einen Ruhezustand übergeht. In der Folge kann sich der Angreifer nicht weiter vermehren und in der Bakterienpopulation ausbreiten.
Eine gängige bakterielle Abwehrmethode, die bisher nicht mit dem Spalten von tRNAs in Verbindung stand, sind CRISPR-Cas-Systeme. CRISPR nutzt RNA-gesteuerte Proteine, sogenannte Cas-Nukleasen (von CRISPR-assoziiert), um Eindringlinge anhand ihres Erbguts zu erkennen und gezielt unschädlich zu machen. Ermitteln sie einen Erreger, führen die Nukleasen eine für jedes System einzigartige Immunantwort aus. Dazu gehört beispielsweise das Schneiden bestimmter Angreifer-DNA oder das Einleiten eines Wachstumsstopps durch umfassenden RNA- und DNA-Abbau. Die Forschung hat sich diese Mechanismen bereits auf vielfältige Weise zunutze gemacht und in CRISPR eine wichtige Grundlage für Technologien zur Genom-Editierung erkannt. Dass CRISPR-Cas im Rahmen einer Immunantwort auch bevorzugt auf tRNAs abzielt, war allerdings nicht bekannt – bis jetzt.
Eine unerwartete Entdeckung
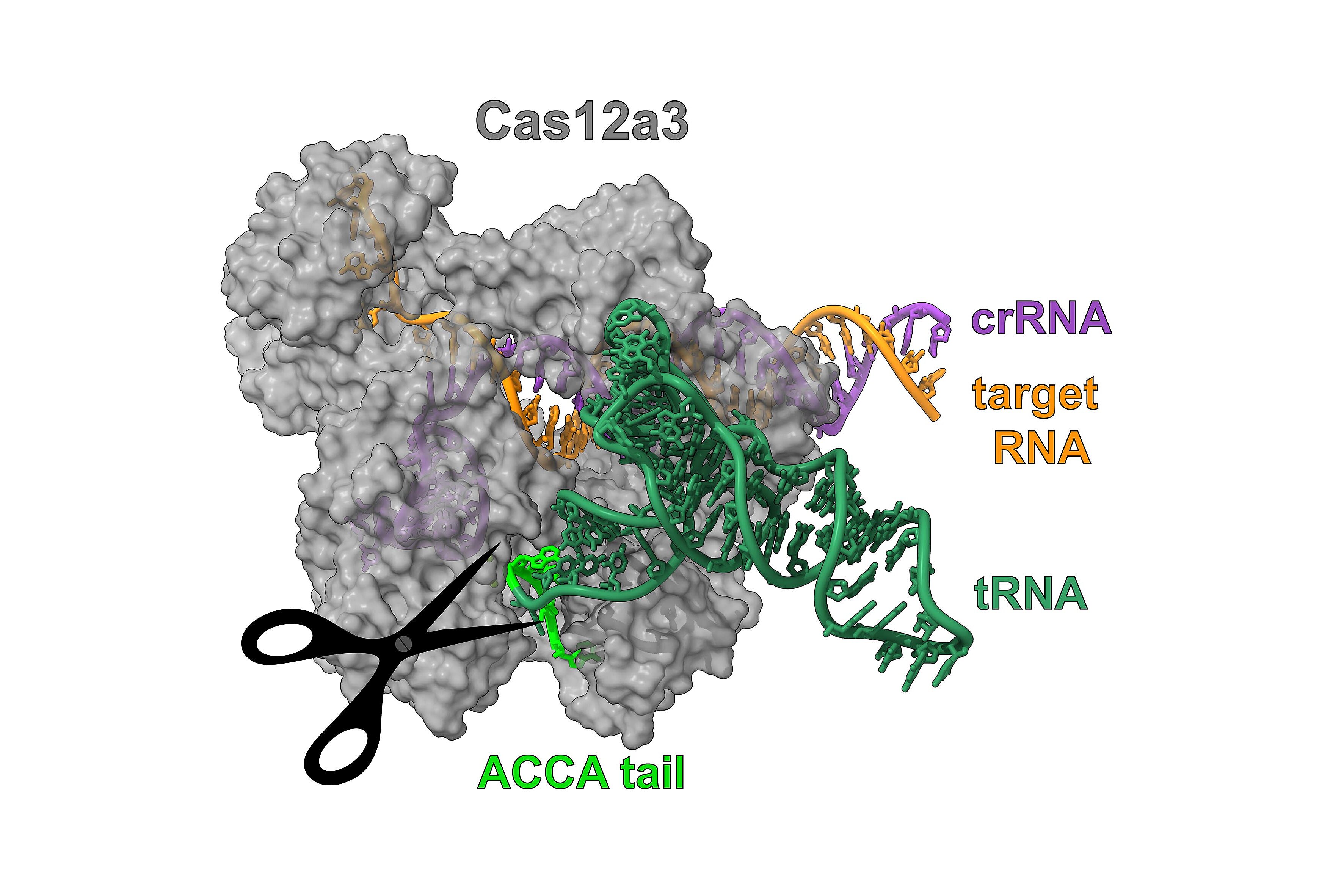
Forschende am Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI), einem Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) in Kooperation mit der Julius-Maximilians-Universität Würzburg (JMU), haben gemeinsam mit Wissenschaftler:innen des HZI und der Utah State University (USU) einen neuartigen CRISPR-Mechanismus entdeckt, der auf eben diese tRNAs abzielt. „Dieser Fund war gänzlich unerwartet“, sagt Chase Beisel, affiliierter Abteilungsleiter am HIRI und korrespondierender Autor der Studie, die heute im Fachmagazin Nature erschienen ist. „Eigentlich hatte sich unser Team mit Proteinen befasst, die mit einer einzigartigen Nuklease namens Cas12a2 in Verbindung stehen“, fügt Beisel hinzu.
In zwei im Januar 2023 in der Zeitschrift Nature veröffentlichten Studien beschrieben Teams, denen auch Chase Beisel angehörte, wie sie Cas12a2 in einer Familie von Nukleasen gefunden hatten, die ausschließlich DNA schneiden. Im Gegensatz dazu war Cas12a2 in der Lage, sowohl RNA als auch DNA weitläufig abzubauen. „Wir stellten die Hypothese auf, dass in dieser Proteinfamilie weitere besondere Funktionen verborgen sein könnten. Und wir hatten Recht: So konnten wir Cas12a3 mit seinen einzigartigen Eigenschaften entdecken“, ergänzt Oleg Dmytrenko, ehemaliger Postdoc im Beisel-Labor und Erstautor der jüngst in Nature erschienenen Studie.