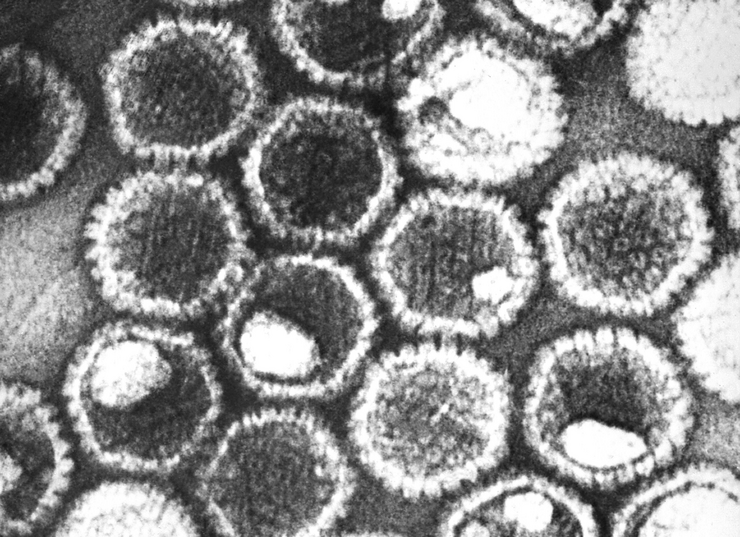
Wenn wir uns Viren und die Immunzellen des Menschen als gegnerische Fußballmannschaften vorstellen, dann beobachten wir ein spektakuläres Spiel: Kaum sind die Viren im Ballbesitz, beginnen sie in Richtung des gegnerischen Tores zu stürmen. Stehen die Abwehrspieler und der Torwart der gegnerischen Mannschaft – also die Immunzellen – nicht schnell genug auf ihrem Posten, kann das Tor nicht verhindert werden – der Mensch wird infiziert.
Doch das menschliche Immunsystem ist extrem wachsam und lernt schnell. Greift ein Virus eine Zelle an, versetzt diese Zelle sich selbst und ihre Nachbarn in einen Alarmzustand. Zusätzlich schüttet sie Botenstoffe aus, um weitere Zellen – die Stürmer und Abwehrspieler – zur Hilfe zu rufen. Die Abwehrspieler, das sind Immunzellen wie Makrophagen, natürliche Killerzellen und dendritische Zellen, eilen nun herbei.
Ist doch ein Tor gefallen, präsentiert die infizierte Zelle außerdem kleine Bruchstücke des Virus auf ihrer Oberfläche. Damit signalisiert sie weiteren Immunzellen, den T-Zellen, dass sie zum Gegenangriff übergehen müssen. Dann werden weitere Stürmer ins Spiel gebracht, die B-Zellen, die Antikörper produzieren und mit T-Zellen ein langfristiges Immungedächtnis erstellen – sie stehen beim nächsten Angriff gut vorbereitet auf ihrem Posten. Unter diesen Bedingungen hat das Virus kaum eine Chance, sich im Körper festzusetzen.