Clever infiziert – Die Tricks der Bakterien
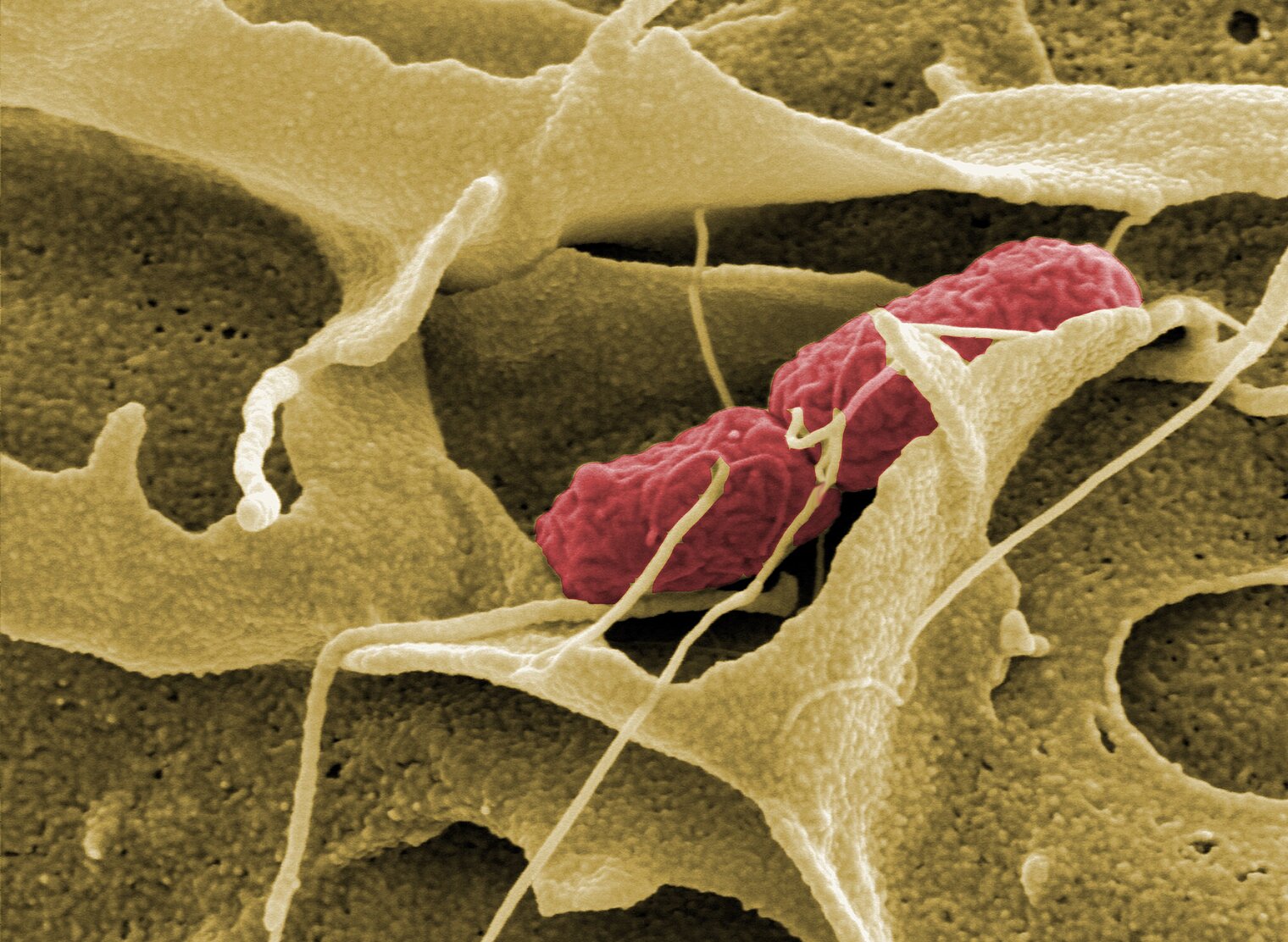
Ein prominentes Beispiel sind Salmonellen, die bei Menschen meist Durchfallerkrankungen verursachen. Häufig gelangen sie über Lebensmittel wie Eier, Fleisch oder Softeis in den Körper und landen schließlich im Darm. Dort heften sie sich an die Epithelzellen und bilden winzige molekulare Spritzen aus. Mit diesem sogenannten Typ-3-Sekretionssystem injizieren sie verschiedene Substanzen in die Darmzellen und starten einen erstaunlichen Mechanismus: Über Signalstoffe veranlassen sie die Darmzellen dazu, Membranen auszustülpen und damit die Bakterien zu umhüllen. Die manipulierte Zelle nimmt die Salmonellen schließlich auf – der Wirt lässt den Feind also selbst herein. Ungehindert können sich die Salmonellen nun in den Darmzellen vermehren. Für den Fall, dass sie durch ein Antibiotikum in Stress versetzt werden, können Salmonellen ihre Zellteilung wieder reduzieren und in eine Art Ruhezustand eintreten. Da viele Antibiotika nur sich teilende Bakterien abtöten, überdauern die Salmonellen mit dieser Strategie den Angriff als Schläferzellen oder Persister, wie sie im Fachjargon genannt werden.
Ähnliche Tricks haben auch krankheitserregende Stämme des Darmbakteriums Escherichia coli auf Lager: „Sie regen ihre Wirtszellen dazu an, Ausstülpungen auf der Oberfläche zu bilden“, sagt Manfred Rohde, der am Helmholtz-Zentrum für Infektionsforschung (HZI) die zentrale Einheit für Mikroskopie leitet. „Über diese als Podeste bezeichneten Strukturen nimmt die irregeführte Zelle Kontakt zu den Bakterien auf – das ist der erste Schritt zur Infektion.“
Um es sich im Darm gemütlich machen zu können, besitzt E. coli kleine Pumpen in seinen Membranen, die giftige Substanzen wie die Gallensalze des Darms aus der Bakterienzelle befördern. Da diese Efflux-Pumpen auch Antibiotika beseitigen können, sind Infektionen mit krankheitserregenden E. coli-Stämmen teilweise nur schwer zu behandeln. Zudem können auch sie als Persister überdauern.
Bakterien der Gattung Yersinia sind ebenso einfallsreiche Keime mit dem menschlichen Darm als Ziel. Sie messen mithilfe von RNA-Molekülen – das sind Abschriften der Geninformation – die Umgebungstemperatur und stellen so fest, ob sie im Freien oder in einem Wirt sind. „Bei 37 Grad Celsius entfalten sich die RNA-Thermometer und machen ihre Information zugänglich“, sagt Petra Dersch, Leiterin der Abteilung „Molekulare Infektionsbiologie“ am HZI. „Die Yersinien wissen nun, dass sie im Wirt sind, und wenn sie dann auf Abwehrzellen stoßen, vervielfältigen sie zudem ihre Virulenzplasmide. Diese besonderen DNA-Moleküle tragen die Erbinformation, die die Bakterien erst zu Krankheitserregern macht.“ Damit schaltet Yersinia auf Angriff und injiziert mit molekularen Spritzen Giftstoffe in die Darmzellen. Um langfristig im Wirt zu überdauern, lösen Yersinien ihre Kolonien auf. Als Einzelzellen verstecken sie sich zum Beispiel im Blinddarm und fahren die Bildung eines bestimmten Giftstoffes, CNFY, herunter. So werden sie für das Immunsystem unsichtbar.
Der Scharlach-Erreger Streptococcus pyogenes, der häufig auch Rachen- und Hautentzündungen auslöst, greift direkt in die menschliche Immunantwort ein: Infizierte Wirtszellen setzen den Botenstoff Interleukin-8 frei und rufen damit Abwehrzellen herbei, die die Bakterien bekämpfen sollen. Die Streptokokken besitzen allerdings das Enzym SpyCEP, mit dem sie das Interleukin-8 spalten und so den Hilferuf ihrer Wirtszellen verstummen lassen. Zudem haben Streptokokken noch weitere Schutzmechanismen: „Wie der Krankenhauskeim Staphylococcus aureus können sich Streptokokken in einer dicken Hülle aus Zuckermolekülen einkapseln und so verhindern, dass sie von Abwehrzellen abgebaut werden“, sagt Manfred Rohde.
Besonders schwer zu behandeln ist eine Infektion, bei der sich die Erreger zu einem Biofilm zusammenlagern. Dazu vernetzen sie außerhalb der Zellen Zuckermoleküle zu einer Matrix, in der sie eine dichte Kolonie bilden. So schützen sie sich vor Angriffen des Immunsystems und können auch der Wirkung von Antibiotika über lange Zeit widerstehen.
Neben Streptokokken ist vor allem der Krankenhauskeim Pseudomonas aeruginosa für diese Fähigkeit gefürchtet. Er kann alle Organe des Körpers – und sogar Implantate – befallen und wiederkehrende Lungenentzündungen, Sepsis oder chronische Wundinfektionen auslösen. Zudem sind Pseudomonaden mit Efflux-Pumpen ausgestattet, die Antibiotika aus den Bakterienzellen herauspumpen. Über diese Mechanismen haben sie mittlerweile vielfältige Antibiotikaresistenzen entwickelt. Daher suchen die HZI-Wissenschaftler nach alternativen Wirkstoffen, die die Bakterien schwächen, sie jedoch nicht abtöten und ihnen so keinen Anlass für eine Resistenzbildung geben. Ziele dieser Antivirulenz-Strategie sind zum Beispiel Signalwege oder Moleküle, mit denen die Bakterien die Biofilmbildung einleiten. Andere Ansätze zielen darauf ab, molekulare Spritzen, Haftproteine oder Flagellen, mit denen sich manche Bakterienarten fortbewegen, zu hemmen. „Solche Wirkstoffe würden die Erreger schwächen, sodass das Immunsystem – vielleicht in Kombination mit einem gering dosierten Antibiotikum – sie beseitigen könnte“, sagt Petra Dersch.
Autor: Andreas Fischer
Veröffentlichung: Mai 2018