Virus-like-particle basierte Technologien

Unsere Forschung
Unsere technologieorientierte Forschung basiert auf der Anwendung von rekombinanten virusähnlichen Partikeln (VLP), die durch die Koexpression der strukturellen Proteine des jeweiligen Virus generiert werden können. Die VLP können somit Hüllen echter Viren sehr authentisch imitieren, sind aber selbst nicht Infektiös, was Forschung und Verwendung außerhalb von Laboren mit höheren Sicherheitsstufen ermöglicht.
Solche authentischen VLP können direkt als Impfstoff verwendet werden, ein Beispiel ist der bereits zugelassene Impfstoff Cervix gegen humane Papillomaviren. Wir möchten weitere VLP als potenzielle Impfstoffkandidaten gegen Infektionskrankheiten erforschen und entwickeln. Gleichzeitig dienen solche authentischen VLP in der Diagnostik als Werkzeug, um die Immunantwort z. B. als Reaktion auf eine Impfung oder auch die Verbreitung von Infektionskrankheiten zu evaluieren, was besonders unter dem Aspekt des Klimawandels im Sinne des One Health-Ansatzes relevant ist.
Zusätzlich sind modifizierte VLP wichtige Werkzeuge für die Grundlagenforschung. Modifizierungen im Inneren des VLP, beispielsweise das Einbringen eines Fluoreszenzproteins, das die authentische VLP-Oberfläche nicht verändert, ermöglichen z. B. Untersuchungen von Infektionsmechanismen.
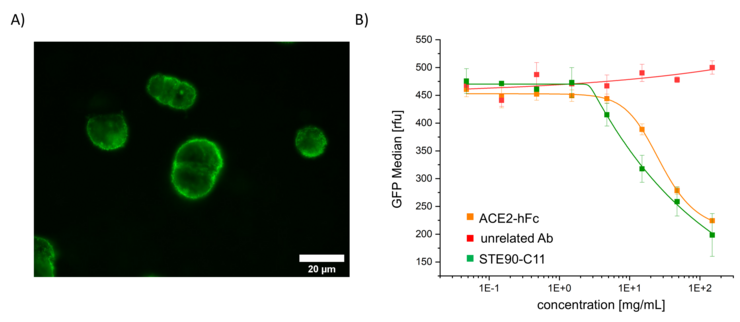
Aber auch für die Wirkstoffentwicklung können diese VLP eingesetzt werden, da die Inhibition von Bindung und die Fusion von VLP und Zelle durch einen Wirkstoff im Hochdurchsatzverfahren gemessen und quantifiziert werden kann (Abbildung 1). Wirkstoffe wie z. B. neutralisierende Antikörper können somit schnell, effektiv und in Laboren mit geringerem Sicherheitslevel analysiert werden, was ein wichtiger Schritt hinsichtlich pandemischer Resilienz ist.
Darüber hinaus forschen wir an rekombinanten VLP, die über Modifizierungen gerichtet und besonders effizient Wirkstoffe in Zielzellen einbringen, was bisher immer noch eine große Herausforderung für verschiedene Therapieansätze ist. Hier möchten wir auch Lösungsansätze für latente Virusinfektionen erarbeiten.
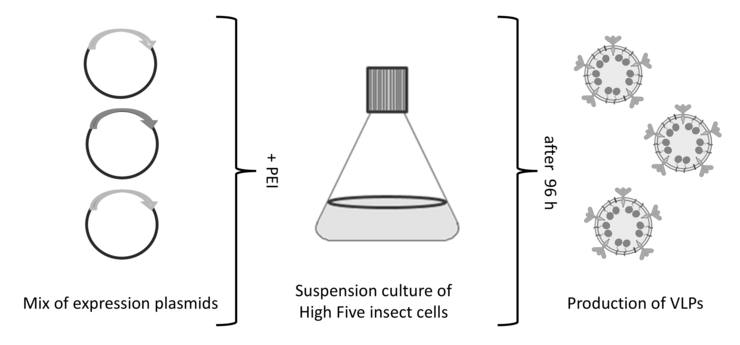
Zur Herstellung der VLP nutzen wir hauptsächlich Plasmid-basierte Expression in Insektenzellen (Abbildung 2), ein sehr effizientes System für die Expression von VLP (Lampinen et al. 2024). Im Vergleich zu den sonst häufig für Insektenzellen genutzten baculoviralen Systemen bleibt die Vitalität der Zellen über den Produktionsprozess hoch und es werden keine baculoviralen Partikel und Proteine parallel zu den rekombinanten VLP produziert. Dies steigert die VLP-Qualität. Zusätzlich ist das System sehr flexibel und erlaubt die einfache Anpassung einzelner Proteine bzw. Produktionsraten über den Austausch der jeweiligen Plasmide bzw. Verhältnisse.
Unsere Forschung
Unsere technologieorientierte Forschung basiert auf der Anwendung von rekombinanten virusähnlichen Partikeln (VLP), die durch die Koexpression der strukturellen Proteine des jeweiligen Virus generiert werden können. Die VLP können somit Hüllen echter Viren sehr authentisch imitieren, sind aber selbst nicht Infektiös, was Forschung und Verwendung außerhalb von Laboren mit höheren Sicherheitsstufen ermöglicht.
Solche authentischen VLP können direkt als Impfstoff verwendet werden, ein Beispiel ist der bereits zugelassene Impfstoff Cervix gegen humane Papillomaviren. Wir möchten weitere VLP als potenzielle Impfstoffkandidaten gegen Infektionskrankheiten erforschen und entwickeln. Gleichzeitig dienen solche authentischen VLP in der Diagnostik als Werkzeug, um die Immunantwort z. B. als Reaktion auf eine Impfung oder auch die Verbreitung von Infektionskrankheiten zu evaluieren, was besonders unter dem Aspekt des Klimawandels im Sinne des One Health-Ansatzes relevant ist.
Zusätzlich sind modifizierte VLP wichtige Werkzeuge für die Grundlagenforschung. Modifizierungen im Inneren des VLP, beispielsweise das Einbringen eines Fluoreszenzproteins, das die authentische VLP-Oberfläche nicht verändert, ermöglichen z. B. Untersuchungen von Infektionsmechanismen.
Aber auch für die Wirkstoffentwicklung können diese VLP eingesetzt werden, da die Inhibition von Bindung und die Fusion von VLP und Zelle durch einen Wirkstoff im Hochdurchsatzverfahren gemessen und quantifiziert werden kann (Abbildung 1). Wirkstoffe wie z. B. neutralisierende Antikörper können somit schnell, effektiv und in Laboren mit geringerem Sicherheitslevel analysiert werden, was ein wichtiger Schritt hinsichtlich pandemischer Resilienz ist.
Darüber hinaus forschen wir an rekombinanten VLP, die über Modifizierungen gerichtet und besonders effizient Wirkstoffe in Zielzellen einbringen, was bisher immer noch eine große Herausforderung für verschiedene Therapieansätze ist. Hier möchten wir auch Lösungsansätze für latente Virusinfektionen erarbeiten.
Zur Herstellung der VLP nutzen wir hauptsächlich Plasmid-basierte Expression in Insektenzellen (Abbildung 2), ein sehr effizientes System für die Expression von VLP (Lampinen et al. 2024). Im Vergleich zu den sonst häufig für Insektenzellen genutzten baculoviralen Systemen bleibt die Vitalität der Zellen über den Produktionsprozess hoch und es werden keine baculoviralen Partikel und Proteine parallel zu den rekombinanten VLP produziert. Dies steigert die VLP-Qualität. Zusätzlich ist das System sehr flexibel und erlaubt die einfache Anpassung einzelner Proteine bzw. Produktionsraten über den Austausch der jeweiligen Plasmide bzw. Verhältnisse.
Rekombinante virusähnliche Partikel sind eine vielseitige und wertvolle Technologie zur Erforschung und Bekämpfung von Infektionskrankheiten.

Dr. Maren Schubert (geb. Bleckmann) studierte Biotechnologie an der TU Braunschweig und promovierte 2016 am HZI in der Gruppe Rekombinante Proteinexpression. Während ihrer Promotion entwickelte sie ein neuartiges Baculovirus-freies Expressionssystem für Insektenzellen sowie zellbasierte Screening-Assays. Danach wurde sie Leiterin der Plattform für rekombinante Proteinexpression am Rudolf-Virchow-Zentrum in Würzburg, wo sie für die Produktion von diversen Proteinen für verschiedene Projekte verantwortlich war. In 2018 kehrte sie zurück an die TU Braunschweig, um sich in der Abteilung Biotechnologie mit Antigen- und Antikörperexpressionssystemen sowie der Entwicklung von zellulären Assays zu befassen. So konnten die in ihrem Insektenzellsystem produzierten Antigene u. a. für die Entwicklung von anti-COVID-19-Antikörpern (u.a. COR101, NCT04674566) und in verschiedenen diagnostischen Studien genutzt werden. Darüber hinaus entwickelte sie auf virusähnlichen Partikeln (VLP) basierende Systeme zur Erzeugung, Bewertung und Entwicklung monoklonaler Antikörper. Ab September 2025 ist sie nun zurück am HZI als HUMAN-Nachwuchsgruppenleiterin und fokussiert sich hier auf VLP-basierte Technologien zur erfolgreichen Bekämpfung von Infektionskrankheiten.
Team



Ausgewählte Publikationen
Lampinen, V., Gröhn, S., Lehmler, N., Jartti, M., Hytönen, V.P., Schubert, M.* & Hankaniemi, M.M.* (2024). Production of norovirus-, rotavirus-, and enterovirus-like particles in insect cells is simplified by plasmid-based expression. Scientific Reports 14:14874 DOI: 10.1038/s41598-024-65316-6
Jaron, M., Lehky, M., Zarà, M., Zaydowicz, C.N., Lak, A., Ballmann, R., Heine, P.A., Wenzel, E.V., Schneider, K.-T., Bertoglio, F., Kempter, S., Köster, R.W., Barbieri, S.S., Van den Heuvel, J., Hust, M., Dübel, S., & Schubert, M.* (2022). Baculovirus-Free SARS-CoV-2 Virus Like Particle Production in Insect Cells for Rapid Neutralization Assessment. Viruses 14: 2087 DOI: 10.3390/v14102087
Schubert, M., Bertoglio, F., Steinke, S., Heine, P.A., Ynga-Durand, M.A., Maass, H., Sammartino, J.C., Cassaniti, I., Zuo, F., Du, L., Korn, J., Milošević, M., Wenzel, E.V., Krstanović, F., Polten, S., Pribanić-Matešić, M., Brizić, I., Baldanti, F., Hammarström, L., Dübel, S., Šustić, A., Marcotte, H., Strengert, M., Protić, A., Piralla, A., Pan-Hammarström, Q., Čičin-Šain, L. & Hust, M. (2022). Human serum from SARS-CoV-2 vaccinated and COVID-19 patients shows reduced binding to the RBD of SARS-CoV-2 Omicron variant. BMC Medicine 20:102 DOI: 10.1186/s12916-022-02312-5
Korn, J., Schäckermann, D., Kirmann, T., Bertoglio, F., Steinke, S., Heisig, J., Ruschig, M., Rojas, G., Langreder, N., Wenzel, E.V., Roth, K.D.R., Becker, M., Meier, D., van den Heuvel, J., Hust, M., Dübel, S. & Schubert, M.* (2020). Baculovirus-free insect cell expression system for high yield antibody and antigen production. Scientific Reports 10: 21393 DOI: 10.3390/v14102087
Bleckmann, M.*, Schürig, M., Endres, M., Samuels, A., Gebauer, D., Konisch, N. & Van den Heuvel, J.* (2019). Identifying parameters to improve the reproducibility of transient expression in High Five cells. PLoS ONE; 14(6):e0217878 DOI: 10.1371/journal.pone.0217878
(* Corresponding author)
Eine vollständige Liste der Publikationen finden Sie hier.