Pharmakokinetik und Pharmakodynamik

Unsere Forschung
Innerhalb der PK/PD Einheit ist es unser Ziel, neuartige Anti-Infektiva präklinisch zu charakterisieren. Damit leisten wir einen entscheidenden Beitrag, um die Entwicklung dieser neuartigen Anti-Infektiva als Medikamente für die Anwendung am Menschen zur Bekämpfung von Infektionskrankheiten voran zu treiben. Die PK/PD Einheit komplettieren auf diese Weise die strategischen Ziele der Abteilung Chemische Biologie durch ihre pharmakologische Expertise.
Wir verwenden standardisierte in vitro und in vivo Methoden, um diese Ziele zu erreichen. Als in vitro Methoden werden klassische ADMET- (Adsorption, Distribution, Metabolismus, Exkretion, Toxizität) Studien durchgeführt, um zunächst festzustellen, ob sich Substanzen für die weitere Entwicklung eignen oder ob gegebenenfalls weitere (chemische) Modifikationen an einem Molekül notwendig sind, um es beispielsweise stabiler oder verträglicher zu machen. Unser Pathogen-Fokus liegt hier auf antibakteriellen, antiviralen, antiparasitären und antifungalen Wirkstoffen. Zudem charakterisieren wir ebenfalls „Pathoblocker“, also Wirkstoffe, die Virulenzmechanismen und nicht den Mikroorganismus selbst angreifen. Erst nach erfolgreicher in vitro Charakterisierung werden in vivo Studien durchgeführt. Hier liegt unser Fokus auf pharmakokinetischen und pharmakodynamischen Studien, die notwendig sind, um am komplexen Gesamtorganismus zu evaluieren, welches Entwicklungspotential eine Substanz als Medikament für die Bekämpfung von Infektionen beim Menschen hat.
Zudem entwickeln wir in silico Methoden, wie zum Beispiel physiologiebasierte Pharmakokinetik/Pharmakodynamik-Modelle, basierend auf in vitro ADMET und mechanistischen Studien sowie teilweise in vivo Studien. Es ist unser Ziel, damit pharmakokinetisches Verhalten von Substanzklassen oder die Wirksamkeit von Substanzen in silico vorhersagen zu können. Auch wenn diese Technologie für die präklinische Anwendung noch in den Kinderschuhen steckt, so ist es unser Ziel, diese Methoden weiterzuentwickeln, um die in vivo-Testung durch besser prädiktive Modelle perspektivisch weiter zu reduzieren sowie die Entwicklung von neuartigen Anti-Infektiva zu beschleunigen. Auf diese Weise sollen sichere und effektive Medikamente schneller den Patienten erreichen können.
Wir sind in Projekten des Deutschen Zentrums für Infektionsforschung (DZIF), in EU-Projekten (PanViPrep) sowie in Projekten mit CARB-X involviert und unterstützen diese aktiv mit pharmakologischer Expertise.
Unsere Forschung
Innerhalb der PK/PD Einheit ist es unser Ziel, neuartige Anti-Infektiva präklinisch zu charakterisieren. Damit leisten wir einen entscheidenden Beitrag, um die Entwicklung dieser neuartigen Anti-Infektiva als Medikamente für die Anwendung am Menschen zur Bekämpfung von Infektionskrankheiten voran zu treiben. Die PK/PD Einheit komplettieren auf diese Weise die strategischen Ziele der Abteilung Chemische Biologie durch ihre pharmakologische Expertise.
Wir verwenden standardisierte in vitro und in vivo Methoden, um diese Ziele zu erreichen. Als in vitro Methoden werden klassische ADMET- (Adsorption, Distribution, Metabolismus, Exkretion, Toxizität) Studien durchgeführt, um zunächst festzustellen, ob sich Substanzen für die weitere Entwicklung eignen oder ob gegebenenfalls weitere (chemische) Modifikationen an einem Molekül notwendig sind, um es beispielsweise stabiler oder verträglicher zu machen. Unser Pathogen-Fokus liegt hier auf antibakteriellen, antiviralen, antiparasitären und antifungalen Wirkstoffen. Zudem charakterisieren wir ebenfalls „Pathoblocker“, also Wirkstoffe, die Virulenzmechanismen und nicht den Mikroorganismus selbst angreifen. Erst nach erfolgreicher in vitro Charakterisierung werden in vivo Studien durchgeführt. Hier liegt unser Fokus auf pharmakokinetischen und pharmakodynamischen Studien, die notwendig sind, um am komplexen Gesamtorganismus zu evaluieren, welches Entwicklungspotential eine Substanz als Medikament für die Bekämpfung von Infektionen beim Menschen hat.
Zudem entwickeln wir in silico Methoden, wie zum Beispiel physiologiebasierte Pharmakokinetik/Pharmakodynamik-Modelle, basierend auf in vitro ADMET und mechanistischen Studien sowie teilweise in vivo Studien. Es ist unser Ziel, damit pharmakokinetisches Verhalten von Substanzklassen oder die Wirksamkeit von Substanzen in silico vorhersagen zu können. Auch wenn diese Technologie für die präklinische Anwendung noch in den Kinderschuhen steckt, so ist es unser Ziel, diese Methoden weiterzuentwickeln, um die in vivo-Testung durch besser prädiktive Modelle perspektivisch weiter zu reduzieren sowie die Entwicklung von neuartigen Anti-Infektiva zu beschleunigen. Auf diese Weise sollen sichere und effektive Medikamente schneller den Patienten erreichen können.
Wir sind in Projekten des Deutschen Zentrums für Infektionsforschung (DZIF), in EU-Projekten (PanViPrep) sowie in Projekten mit CARB-X involviert und unterstützen diese aktiv mit pharmakologischer Expertise.
Dr. Katharina Rox
„Mit innovativen, pharmakologischen Methoden charakterisieren wir neuartige Anti-Infektiva, um auch in Zukunft Infektionskrankheiten effektiv bekämpfen zu können.“
Katharina Rox studierte Pharmazie an der Westfälischen Wilhelms-Universität in Münster, gefördert durch die Studienstiftung des deutschen Volkes. Ihr praktisches Jahr verbrachte sie in einer öffentlichen Apotheke und bei Bayer HealthCare Pharmaceuticals in Berlin in der pharmakologischen Forschung.
Sie promovierte 2015 an der Universität des Saarlandes. Hierbei beschäftigte sie sich in den Gruppen von Prof. Dr. Gursharan Singh Chhatwal (Helmholtz-Zentrum für Infektionsforschung Braunschweig) und von Prof. Dr. Rolf Müller (Helmholtz Institut für Pharmazeutische Forschung Saarland) sowie als Gast in der Gruppe von Prof. Dr. Mark J. Walker (University of Queensland, Brisbane, Australien) mit der Identifizierung und Charakterisierung von Pathoblockern gegen Streptokokken-Infektionen.
Danach wechselte sie in die HZI-Abteilung „Chemische Biologie“, wo sie seit 2015 die Pharmakokinetik/ Pharmakodynamik-Einheit innerhalb des Deutschen Zentrums für Infektionsforschung (DZIF) aufbaute und leitete. Im Jahr 2019 ging sie für einen zweimonatigen Forschungsaufenthalt ans RIKEN in Yokohama (Japan), wo sie sich in der Gruppe von Prof. Yuichi Sugiyama mit der Physiologie-basierten Pharmakokinetik / Pharmakodynamik-Modellierung und der Cross-Spezies-Extrapolation beschäftigte.
Seit 2025 leitet sie die Forschungsgruppe Pharmakokinetik/ Pharmakodynamik am Helmholtz-Zentrum für Infektionsforschung (HZI). Ihre Arbeiten konzentrieren sich auf die präklinische Entwicklung neuartiger Anti-Infektiva. Zudem verwendet sie mit ihrem Team innovative in vitro und in silico Modelle zum besseren Verständnis von pharmakokinetischen und pharmakodynamischen Korrelationen, wie das hollow-fiber Infektionsmodell oder pharmakokinetisches/ pharmakodynamisches Modelling. Zusätzlich entwickeln Rox und ihr Team neuartige bioanalytische Methoden, um neuartige Therapiekonzepte oder Biomarker in verschiedenen Matrizes effektiv zu bestimmen.














Ausgewählte Publikationen
- Charoenpattarapreeda J, Tegge W, Xu C, Harmrolfs K, Hinkelmann B, Wullenkord H, Hotop S-K, Beutling U, Rox K, Brönstrup M. A targeted click-to-release activation of the last-resort antibiotic colistin reduces its renal cell toxicity. 2024. Angew Chem Int Ed. 63(47):e202408360. doi: 10.1002/anie.202408360
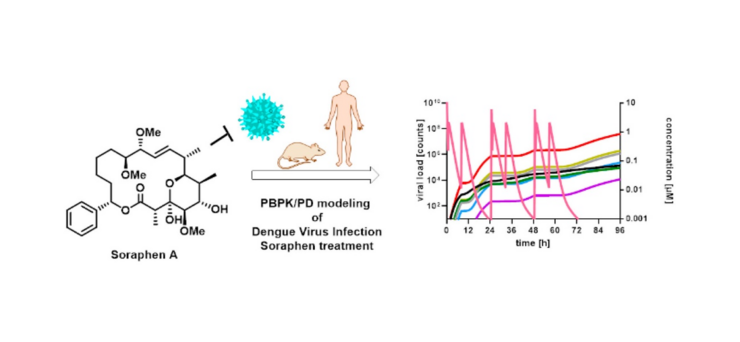
- Rox K, Jansen R, Lukežič T, Greweling-Pils M, Herrmann J, Miethke M, Hüttel S, Hennessen F, Abou Fayad A, Holzhausen C, Lundberg CV, Teague J, Sundarman E, Bülter L, Hesterkamp T, Stadler M, Brönstrup M#, Müller R#. Pharmacokinetic and pharmacodynamic evaluation of the atypical tetracyclines chelocardin and amidochelocardin in murine infection models. 2024. Microbiol Spectr. 12(1):e0128923. doi: 10.1128/spectrum.01289-23
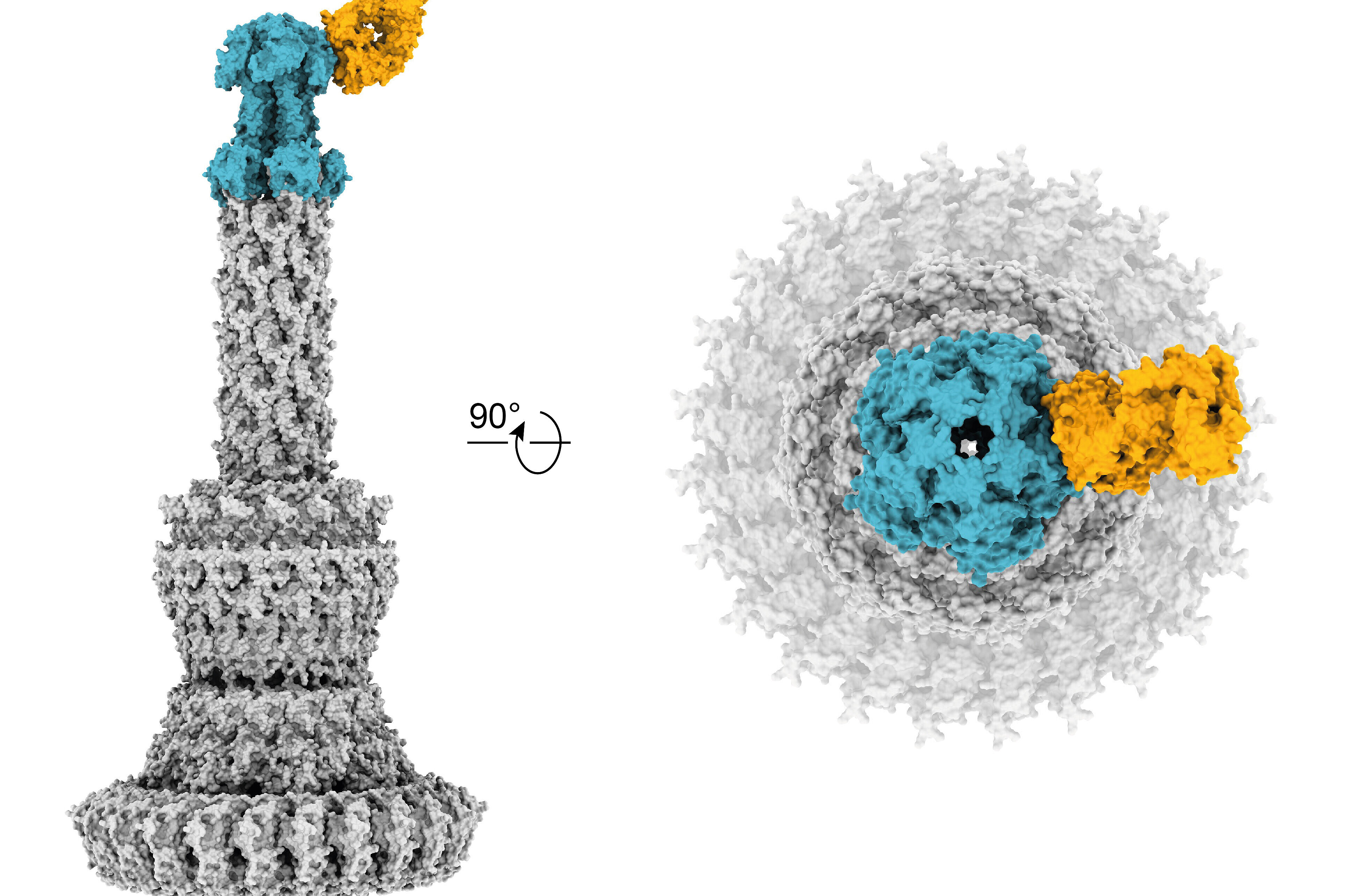
- Simonis A*,#, Kreer C*, Albus A, Rox K, Yuan B, Holzmann D, Wilms JA, Zuber S, Kottege L, Winter S, Meyer M, Schmitt K, Gruell H, Theobald SJ, Hellmann A.-M., Meyer C, Ercanoglu MS, Cramer N, Munder A, Hallek M, Fätkenheuer G, Koch M, Seifert H, Rietschel E, Marlovits TC, van Koningsbruggen-Rietschel S, Klein F, Rybniker J#. Discovery of highly neutralizing human antibodies targeting multidrug-resistant Pseudomonas aeruginosa. 2023. Cell. 186(23):5098-5113. doi: 10.1016/j.cell.2023.10.002
- Konstantinovic J, Kany AM*, Alhayek A*, Sikandar A, Voos K, Abdelsamie AS, Yao Y, Andreas A, Shafiei R, Loretz B, Schönauer E, Bals R, Brandstetter H, Hartmann RW, Ducho C, Lehr C.-M., Beisswenger C, Müller R, Rox K, Haupenthal J, Hirsch AKH. Inhibitors of the Elastase LasB for the treatment of Pseudomonas aeruginosa lung infections. 2023. ACS Cent Sci. 9(12):2205-2215. doi: 10.1021/acscentsci.3c01102
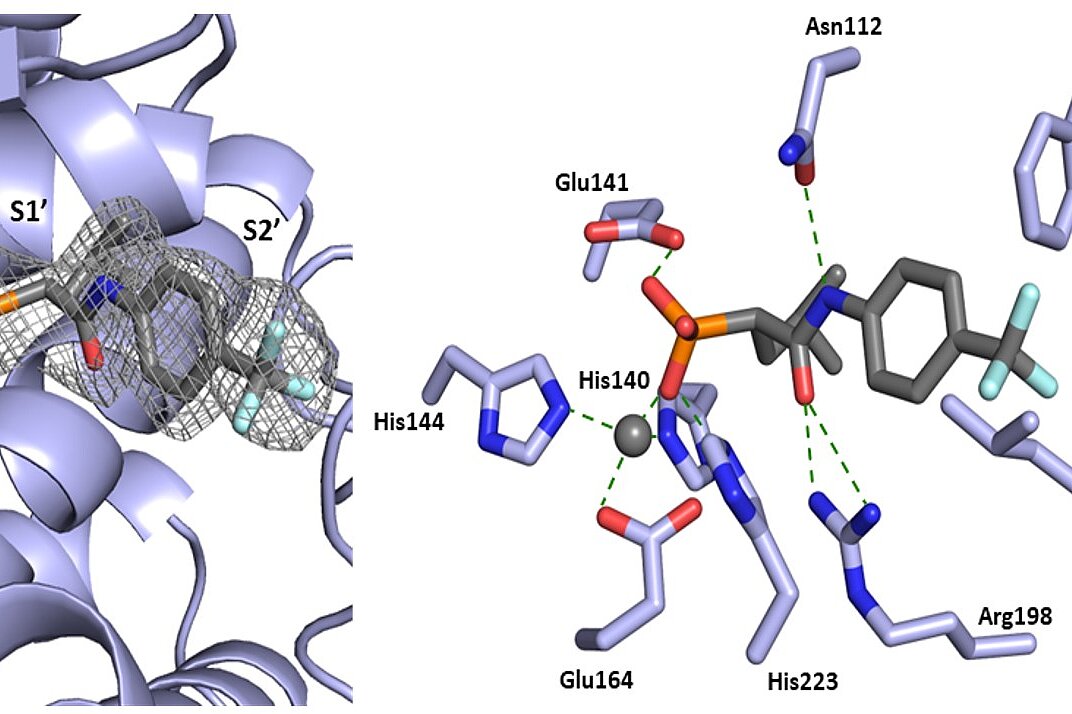
- Zhang L, Lin D, Sun X, Curth U, Drosten C, Sauerhering L, Becker S, Rox K, Hilgenfeld R. Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved alpha-ketoamide inhibitors. 2020. Science. 368(6489):409-412. doi: 10.1126/science.abb3405