Molekulare Strukturbiologie

Unsere Forschung
Der Forschungsschwerpunkt der Abteilung Molekulare Strukturbiologie liegt auf der hochauflösenden Strukturaufklärung großer makromolekularer Komplexe und Maschinen, die für Infektionsprozesse von Bedeutung sind. Dabei kommen modernste Methoden wie Einzelpartikel-Kryo-Elektronenmikroskopie (Kryo-EM) und Röntgenkristallographie zum Einsatz. Die strukturbiologischen Analysen werden durch ein breites Spektrum molekularbiologischer, biochemischer und biophysikalischer Verfahren ergänzt.
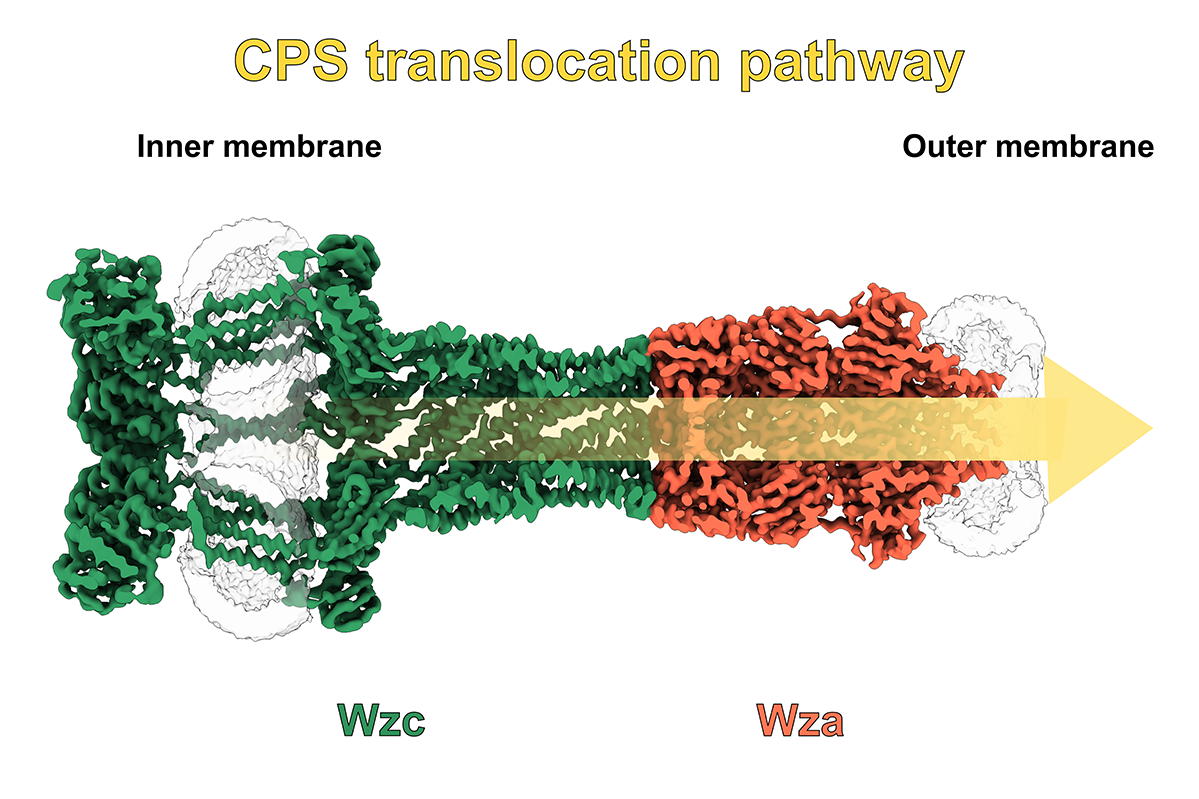
In Zusammenarbeit mit Forschungsgruppen des HZI stehen derzeit neuartige CRISPR/Cas-Nukleasen, Capsid-Polysaccharidtransporter sowie bakterielle Naturstoff-Megasynthasen im Fokus der Arbeiten. Ein weiteres wichtiges Ziel ist die Entwicklung innovativer Pathoblocker, die gezielt bakterielle Virulenzfaktoren hemmen sollen, um Infektionen effektiver zu kontrollieren und die Entstehung von Resistenzen zu verringern. Neben synthetischen Wirkstoffen und Naturstoffen kommen dabei zunehmend auch Mini-Proteine zum Einsatz, die mithilfe KI-gestützter Protein-Design-Verfahren entwickelt werden.
Unsere Forschung
Der Forschungsschwerpunkt der Abteilung Molekulare Strukturbiologie liegt auf der hochauflösenden Strukturaufklärung großer makromolekularer Komplexe und Maschinen, die für Infektionsprozesse von Bedeutung sind. Dabei kommen modernste Methoden wie Einzelpartikel-Kryo-Elektronenmikroskopie (Kryo-EM) und Röntgenkristallographie zum Einsatz. Die strukturbiologischen Analysen werden durch ein breites Spektrum molekularbiologischer, biochemischer und biophysikalischer Verfahren ergänzt.
In Zusammenarbeit mit Forschungsgruppen des HZI stehen derzeit neuartige CRISPR/Cas-Nukleasen, Capsid-Polysaccharidtransporter sowie bakterielle Naturstoff-Megasynthasen im Fokus der Arbeiten. Ein weiteres wichtiges Ziel ist die Entwicklung innovativer Pathoblocker, die gezielt bakterielle Virulenzfaktoren hemmen sollen, um Infektionen effektiver zu kontrollieren und die Entstehung von Resistenzen zu verringern. Neben synthetischen Wirkstoffen und Naturstoffen kommen dabei zunehmend auch Mini-Proteine zum Einsatz, die mithilfe KI-gestützter Protein-Design-Verfahren entwickelt werden.
Prof. Dirk Heinz
"Seeing is believing" - Die Schönheit der Strukturbiologie liegt in der Tatsache, dass sich aus der gewonnenen Strukturinformation häufig unmittelbar die Funktionsweise des jeweiligen Proteinmoleküls ableiten lässt

Dirk Heinz ist ein deutscher Biochemiker und Strukturbiologe. Er studierte Chemie in Freiburg/Deutschland und promovierte in Strukturbiologie an der Universität Basel/Schweiz. Nach einem Postdoc-Aufenthalt an der University of Oregon und der Habilitation in Freiburg wechselte er als Leiter einer Nachwuchsforschergruppe an das Helmholtz-Zentrum für Infektionsforschung (HZI) und stieg in der Folge zum Abteilungsleiter auf. Im Jahre 2011 übernahm er die Wissenschaftliche Geschäftsführung des Zentrums, eine Position, die er bis Juni 2023 ausfüllte. Seit 2012 ist er Professor für Strukturbiologie an der Technischen Universität Braunschweig. Im Juli 2023 kehrte Dirk Heinz als Leiter der Abteilung Molekulare Strukturbiologie zurück in die aktive Forschung. Dirk Heinz ist EMBO-Mitglied und hält eine Ehrendoktorwürde der Universität Würzburg.








Ausgewählte Publikationen
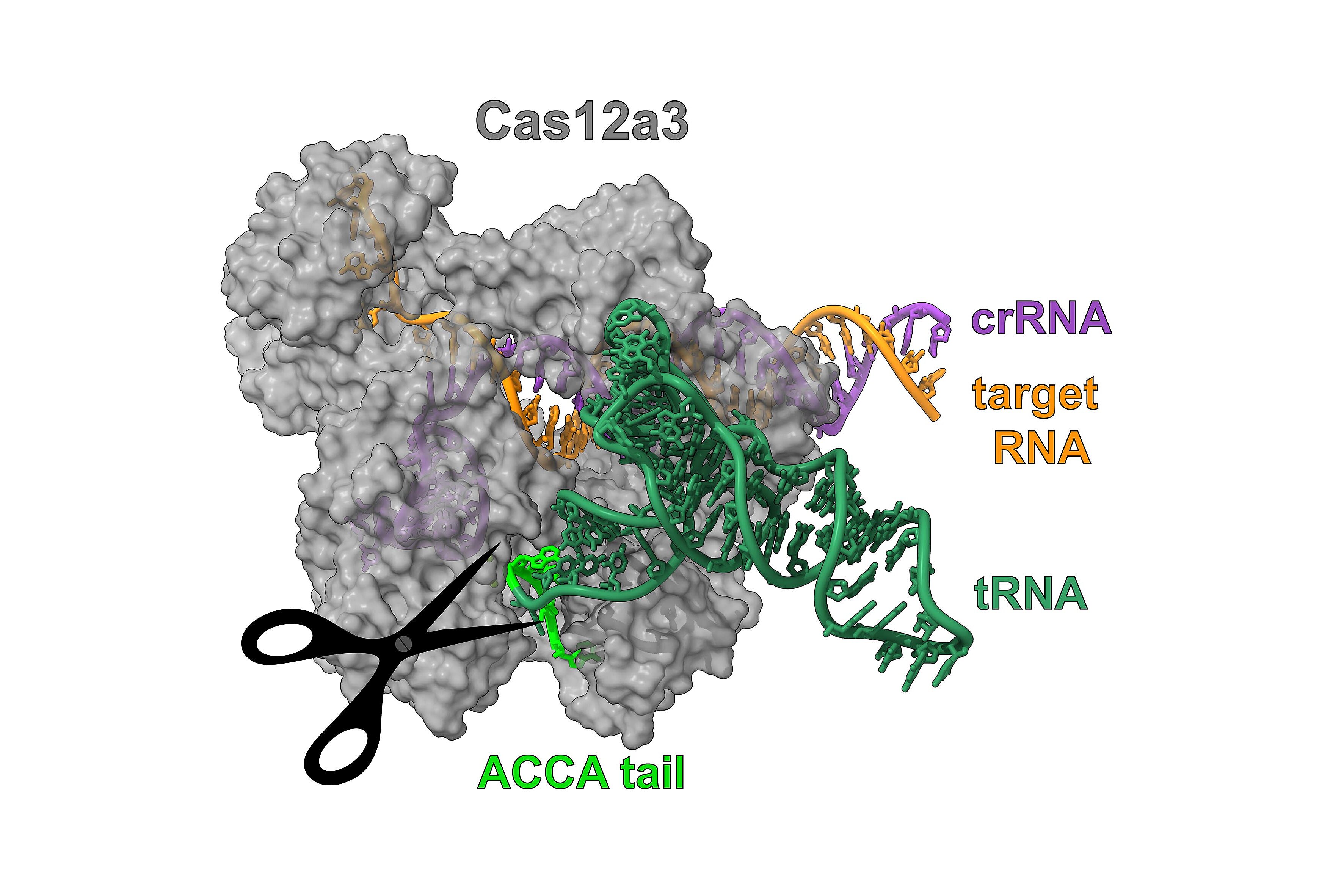
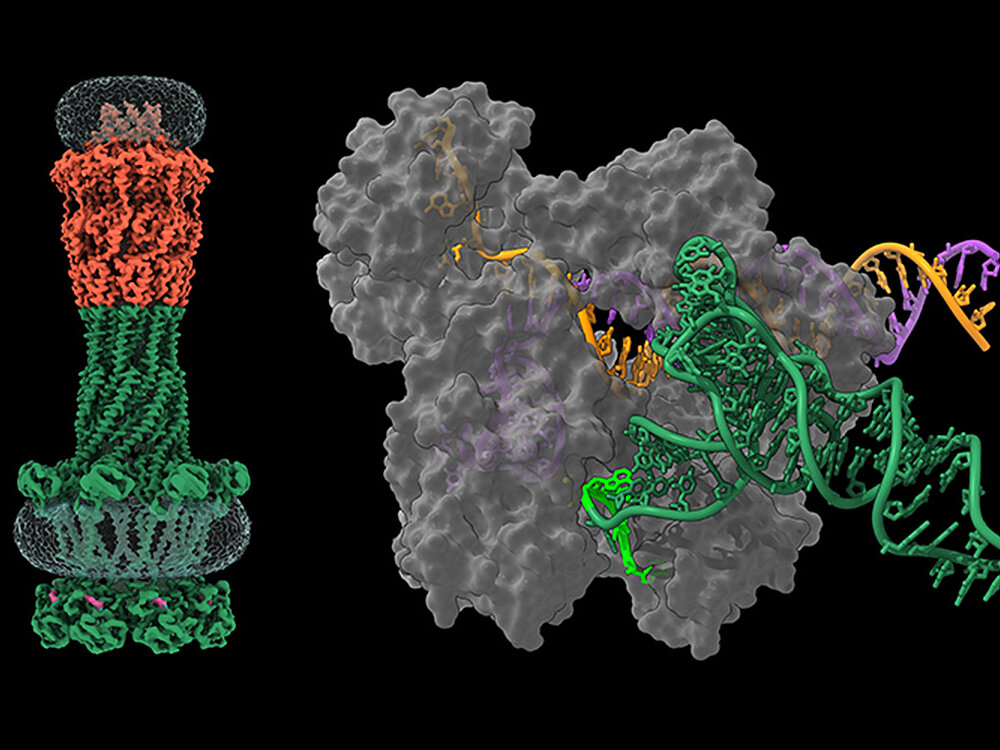
O. Dmytrenko et al., RNA-triggered Cas12a3 cleaves tRNA tails to execute bacterial immuni-ty. Nature, in press (2025).
A. Kling et al., Targeting DnaN for tuberculosis therapy using novel griselimy-cins. Science 348, 1106-1112 (2015).
T. Wollert et al., Extending the host range of Listeria monocytogenes by rational protein de-sign. Cell 129, 891-902 (2007).
H. H. Niemann et al., Structure of the human receptor tyrosine kinase met in complex with the Listeria invasion protein InlB. Cell 130, 235-246 (2007).
W. D. Schubert et al., Structure of internalin, a major invasion protein of Listeria monocyto-genes, in complex with its human receptor E-cadherin. Cell 111, 825-836 (2002).
Publikationen
Eine Übersicht aller Publikationen finden Sie hier