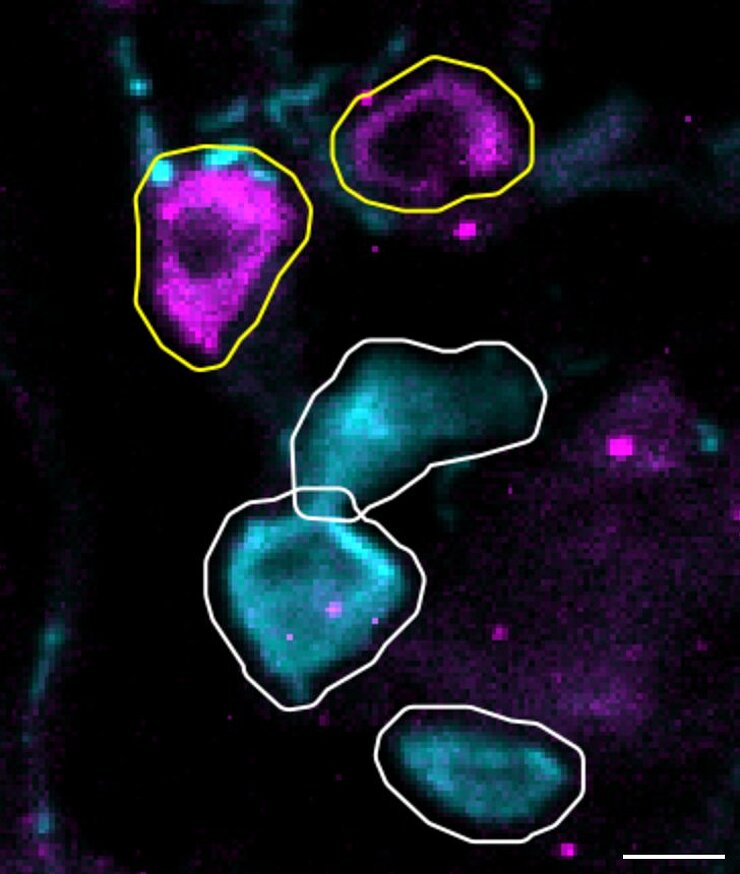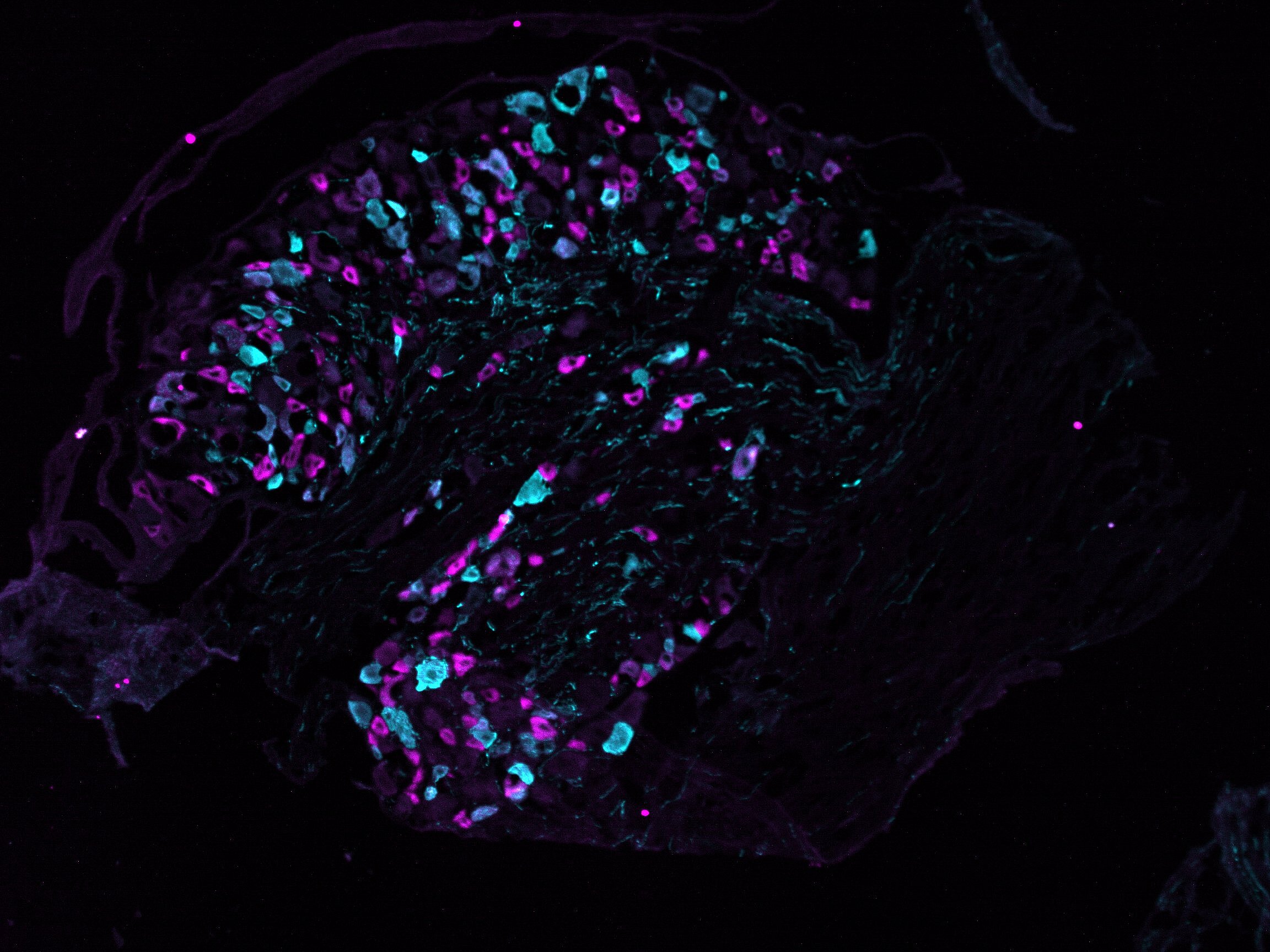
Mechanismen der Infektion und Nozizeption

Unsere Forschung
Infektionskrankheiten stellen eine große Bedrohung für die menschliche Gesundheit dar, wie die COVID-19-Pandemie eindrücklich gezeigt hat. Schmerzen – ein Schutzmechanismus, der auf Schädigungen hinweist – treten häufig im Zusammenhang mit Infektionen auf, entweder direkt oder über immunvermittelte Signalwege. Schmerzen entstehen dabei oft durch Überaktivität peripherer Nerven, insbesondere kleiner bis mittelgroßer sensorischer Neuronen (Nozizeptoren), die in den Spinalganglien (DRG) liegen. Während einer Infektion freigesetzte Entzündungsmediatoren aktivieren Nozizeptoren und lösen Schmerzen aus. So war Myalgie ein auffälliges Symptom von COVID-19 und erhöhte das Risiko für chronische Schmerzen. Herpes-simplex-Viren (HSV) hingegen sind neurotrop und verursachen Schmerzen direkt durch bislang unklare Mechanismen. HSV-1 infiziert weltweit geschätzt 3,8 Milliarden Menschen und führt zu schmerzhaften Bläschen im Mundbereich (WHO). Das Varizella-Zoster-Virus verbleibt nach einer Windpockeninfektion latent in den DRGs und reaktiviert sich bei etwa 30 Prozent der Menschen als Gürtelrose. Diese führt zu schmerzhaften Hautausschlägen, wobei viele Betroffene eine Post-Zoster-Neuralgie entwickeln – ein Zustand, der mit den derzeitigen Therapien nur unzureichend behandelt werden kann. Das Verständnis der Schmerzmechanismen in der Infektionsbiologie ist daher von entscheidender Bedeutung, bleibt jedoch bisher stark untererforscht.
Unsere Forschung nutzt modernste Elektrophysiologie, ultrasensitive Proteomik, Verhaltensphänotypisierung und Zellkulturmethoden, um Folgendes zu untersuchen:
- Wir haben kürzlich das subsetspezifische Proteom von sensorischen Neuronen der Maus kartiert. Da Proteine direkt mit Funktionen verknüpft sind, fragen wir nun: Wie beeinflusst diese Vielfalt die Reaktion auf Krankheitserreger in verschiedenen Mausmodellen? Welche Subtypen sensorischer Neuronen sind anfällig für Virusinfektionen – und warum? Ist die Wirtsantwort virusstammspezifisch?
- Wir entwickeln neue Verhaltensparadigmen, die es ermöglichen, nicht ausgelöstes Schmerz- und Juckreizverhalten bei Mäusen sowohl nach Infektionen als auch nach der Anwendung von Analgetika zu bewerten.
- Wir werden die funktionelle und proteomische Vielfalt menschlicher sensorischer Neuronensubtypen definieren, um Moleküle zu identifizieren, die eine höhere Erfolgschance in der klinischen Anwendung haben.
Unsere Vision ist es, das Forschungsfeld der Nocifection zu begründen – um ein umfassendes mechanistisches Verständnis von Schmerzen während Infektionen, insbesondere durch Viren, zu entwickeln.
Unsere Forschung
Infektionskrankheiten stellen eine große Bedrohung für die menschliche Gesundheit dar, wie die COVID-19-Pandemie eindrücklich gezeigt hat. Schmerzen – ein Schutzmechanismus, der auf Schädigungen hinweist – treten häufig im Zusammenhang mit Infektionen auf, entweder direkt oder über immunvermittelte Signalwege. Schmerzen entstehen dabei oft durch Überaktivität peripherer Nerven, insbesondere kleiner bis mittelgroßer sensorischer Neuronen (Nozizeptoren), die in den Spinalganglien (DRG) liegen. Während einer Infektion freigesetzte Entzündungsmediatoren aktivieren Nozizeptoren und lösen Schmerzen aus. So war Myalgie ein auffälliges Symptom von COVID-19 und erhöhte das Risiko für chronische Schmerzen. Herpes-simplex-Viren (HSV) hingegen sind neurotrop und verursachen Schmerzen direkt durch bislang unklare Mechanismen. HSV-1 infiziert weltweit geschätzt 3,8 Milliarden Menschen und führt zu schmerzhaften Bläschen im Mundbereich (WHO). Das Varizella-Zoster-Virus verbleibt nach einer Windpockeninfektion latent in den DRGs und reaktiviert sich bei etwa 30 Prozent der Menschen als Gürtelrose. Diese führt zu schmerzhaften Hautausschlägen, wobei viele Betroffene eine Post-Zoster-Neuralgie entwickeln – ein Zustand, der mit den derzeitigen Therapien nur unzureichend behandelt werden kann. Das Verständnis der Schmerzmechanismen in der Infektionsbiologie ist daher von entscheidender Bedeutung, bleibt jedoch bisher stark untererforscht.
Unsere Forschung nutzt modernste Elektrophysiologie, ultrasensitive Proteomik, Verhaltensphänotypisierung und Zellkulturmethoden, um Folgendes zu untersuchen:
- Wir haben kürzlich das subsetspezifische Proteom von sensorischen Neuronen der Maus kartiert. Da Proteine direkt mit Funktionen verknüpft sind, fragen wir nun: Wie beeinflusst diese Vielfalt die Reaktion auf Krankheitserreger in verschiedenen Mausmodellen? Welche Subtypen sensorischer Neuronen sind anfällig für Virusinfektionen – und warum? Ist die Wirtsantwort virusstammspezifisch?
- Wir entwickeln neue Verhaltensparadigmen, die es ermöglichen, nicht ausgelöstes Schmerz- und Juckreizverhalten bei Mäusen sowohl nach Infektionen als auch nach der Anwendung von Analgetika zu bewerten.
- Wir werden die funktionelle und proteomische Vielfalt menschlicher sensorischer Neuronensubtypen definieren, um Moleküle zu identifizieren, die eine höhere Erfolgschance in der klinischen Anwendung haben.
Unsere Vision ist es, das Forschungsfeld der Nocifection zu begründen – um ein umfassendes mechanistisches Verständnis von Schmerzen während Infektionen, insbesondere durch Viren, zu entwickeln.
Sampurna Chakrabarti
„Wir erforschen, wie Infektionen Schmerzen auslösen – und gehen dabei jeder einzelnen Zelle auf den Grund.“

Ursprünglich aus Kolkata, Indien, absolvierte Sampurna Chakrabarti einen Bachelor of Science in Biowissenschaften (Schwerpunkt Neurowissenschaften) sowie einen Bachelor of Arts in Psychologie an der University at Buffalo, NY, USA. Anschließend erhielt sie ein Gates-Cambridge-Stipendium für ihre Promotion an der University of Cambridge, UK, wo sie Mechanismen der peripheren Sensibilisierung bei entzündungsbedingten Knieschmerzen erforschte und mehrere Forschungspreise gewann, darunter einen Forschungsaufenthalt am European Molecular Biology Laboratory in Rom, Italien.
Im Jahr 2020 wechselte Sam als Postdoktorandin an das Max-Delbrück-Centrum für Molekulare Medizin in Berlin. Dort untersuchte sie, unterstützt durch ein Alexander-von-Humboldt-Stipendium, Mechanosensation und die Vielfalt sensorischer Neuronen. Während dieser Zeit erhielt sie zudem mehrere unabhängige Forschungsstipendien, darunter das renommierte Grass Fellowship am Marine Biological Laboratory, MA, USA, wo sie schmerzähnliches Verhalten bei Haien untersuchte.
Sam hat mehr als zehn Fachartikel in führenden wissenschaftlichen Zeitschriften veröffentlicht, wirkt als Gutachterin für renommierte Journale wie PAIN und Science Advances und ist Early Career Editorial Fellow beim Journal of Pain. Seit Oktober 2025 leitet sie am HZI die HUMAN-geförderte Forschungsgruppe „Mechanismen der Infektion und Nozizeption“ (PAIN), die infektionsbedingte Veränderungen der Nervenfunktion und deren Beitrag zu Schmerzen bei Maus und Mensch untersucht.
Ausgewählte Publikationen
- Chakrabarti, S. et al. Ultrasensitive proteomics uncovers nociceptor diversity and novel pain targets. bioRxiv 2025.09.20.677124 (2025) DOI: 10.1101/2025.09.20.677124 (Preprint).
- Chakrabarti, S. et al. Touch sensation requires the mechanically gated ion channel ELKIN1. Science 383, 992–998 (2024). DOI: 10.1126/science.adl0495
- Chakrabarti, S. et al. Intraarticular adeno‐associated virus serotype AAV‐PHP. S–mediated chemogenetic targeting of knee‐innervating dorsal root ganglion neurons alleviates inflammatory pain in mice. Arthritis Rheumatol. 72, 1749–1758 (2020). DOI: 10.1002/art.41314
- Chakrabarti, S., Jadon, D. R., Bulmer, D. C. & Smith, E. S. J. Human osteoarthritic synovial fluid increases excitability of mouse dorsal root ganglion sensory neurons: an in-vitro translational model to study arthritic pain. Rheumatology 59, 662–667 (2020). DOI: 10.1093/rheumatology/kez331
- Chakrabarti, S. et al. Sensitization of knee-innervating sensory neurons by tumor necrosis factor-α-activated fibroblast-like synoviocytes: an in vitro, coculture model of inflammatory pain. Pain 161, 2129 (2020). DOI: 10.1097/j.pain.0000000000001890
Publikationen
Eine vollständige Liste der Publikationen finden Sie hier.
Newsroom
Sie haben Interesse an einer Bachelor- oder Masterarbeit? Wir freuen uns auf Ihre Anfrage!