Antivirale Antikörper-Omics

Unsere Forschung
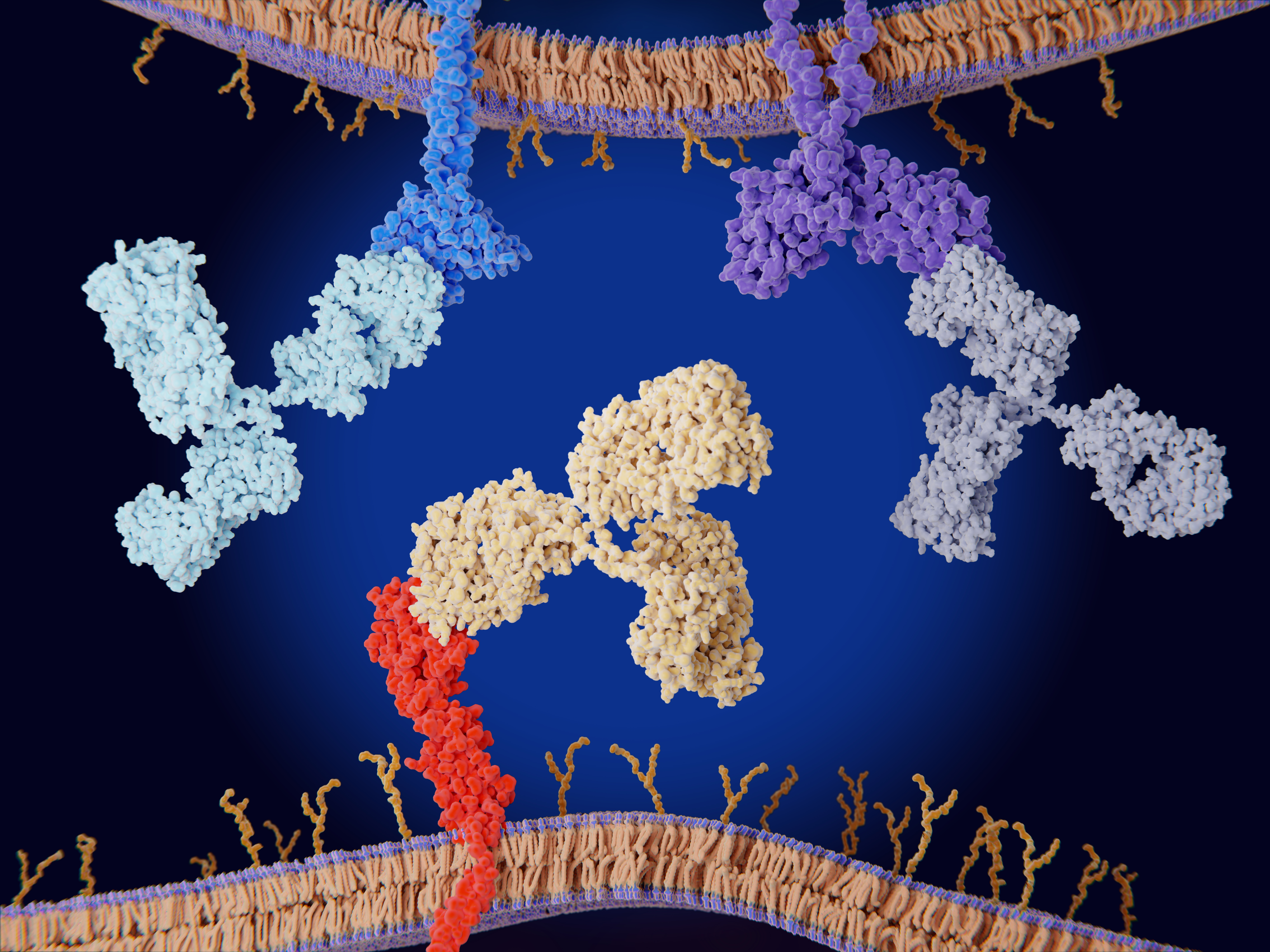
Wenn eine Person mit einem Krankheitserreger infiziert wird, beginnen B-Zellen, enorme Mengen an Antikörpern mit einer einzigartigen Spezifität gegen den Erreger auszuschütten. Die variable Fab-Region des Antikörpermoleküls vermittelt die Antigenbindung und kann so das Eindringen in die entsprechende Wirtszelle „neutralisieren“.
Die Fähigkeit des Immunsystems, schnell und effektiv auf den eindringenden Erreger zu reagieren, hängt neben Neutralisation und Bindung auch von der Fähigkeit der Antikörper ab, weitere Immunmechanismen wie Phagozytose, Zytotoxizität und die Freisetzung von pro-/anti-inflammatorischen Mediatoren über Fc:Fc-Rezeptor-Interaktion auf angeborenen Immunzellen zu induzieren. Diese Fc-vermittelten Mechanismen hängen von einer Reihe von Faktoren ab, einschließlich der Expressionsmuster von aktivierenden und hemmenden Fc-Rezeptoren auf Effektorzellen, der Subklassen- und Isotypenverteilung sowie der Zugänglichkeit des Fc-Teils und posttranslationaler Fc-Modifikationen (z.B. Glykosylierung) der antigen-spezifischen Immunkomplexe.
Die translationalen Projekte in der Forschungsgruppe zielen darauf ab, unser Wissen über die Rolle der Antikörper-Effektorfunktionen bei Infektionskrankheiten zu erweitern, die zugrundeliegenden Mechanismen der Fc:Fc-Rezeptor-Interaktionen zu charakterisieren und neue Ansätze zur Verbesserung antikörperbasierter Therapien zu identifizieren.
Schützende antivirale Immunität – die Natur als Beispiel
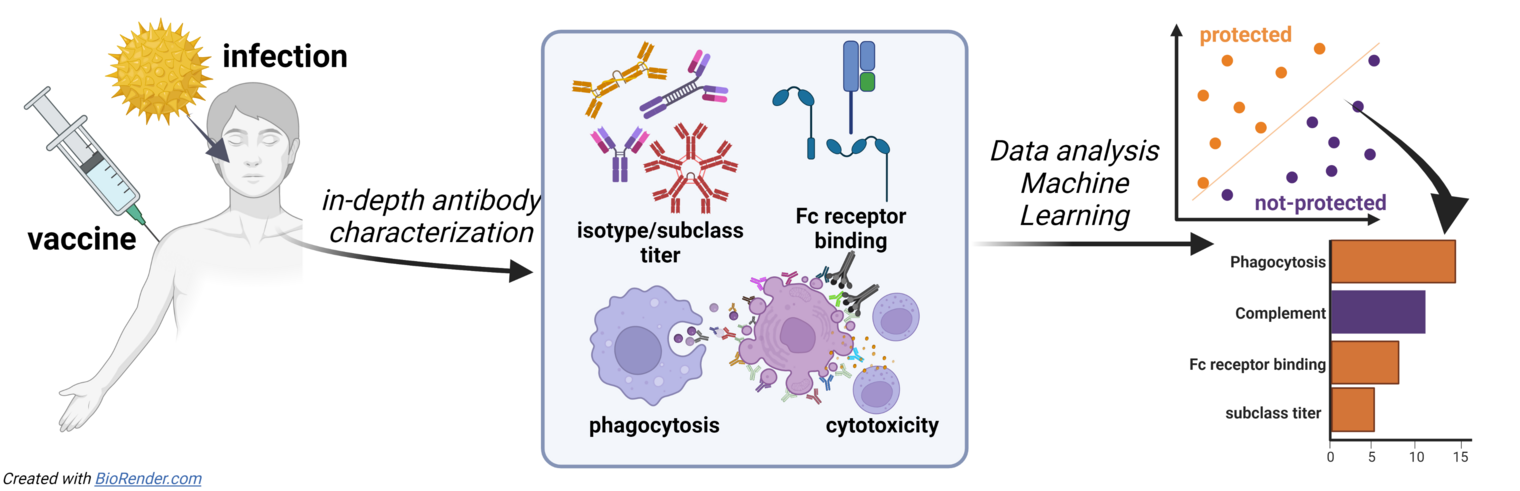
Neue Daten deuten auf die entscheidende Rolle von spezifischen Antikörper-Effektorprofilen bei der Bekämpfung von Infektionskrankheiten hin. Dabei können bestimmte Merkmale, die für bestimmte Erreger schützend sind, in anderen Zusammenhängen wirkungslos oder sogar nachteilig sein. Für das Verständnis schützender Immunantworten wird es entscheidend sein, erregerspezifische Antikörper in humanen Kohorten zu untersuchen und genauestens zu charakterisieren. In diesem Projekt nutzen wir einen systematischen immunbiologischen Ansatz, um schützende Antikörperantworten in verschiedenen Gruppen und Modellen (z.B. nach Infektion oder Impfung) zu charakterisieren. Wir untersuchen eine Reihe von biophysikalischen Eigenschaften, wie zum Beispiel die Subklassen- und Isotypenverteilung, die Fc-Rezeptor-Bindung sowie angeborene Effektorfunktionen wie Phagozytose und Zytotoxizität, um spezifische Merkmale einer schützenden Immunität zu identifizieren.
Nutzung der Antikörper-Fc-Effektorfunktion als therapeutisches Target
Monoklonale Antikörper sind hochwirksame therapeutische Moleküle. Sie haben die Behandlung von Krebs und entzündlichen Erkrankungen revolutioniert. Auch bei Infektionskrankheiten gibt es zunehmend Erfolge, therapeutische Antikörper gegen Viren zu entwickeln und auf den Markt zu bringen. Die meisten, wenn nicht alle, anti-viralen monoklonalen Antikörper wurden aufgrund ihrer Fähigkeit, Pathogene zu neutralisieren und zu blockieren, ausgewählt.
In unserem aktuellen Forschungsprojekt wollen wir noch einen Schritt weitergehen und bestehende monoklonale Antikörpertherapien durch die Optimierung ihrer Fc-Effektorfunktionen verbessern. Indem wir die Bedeutung der Fc-Effektorfunktionen nutzen, wollen wir neuartige Therapieansätze aufzeigen, die noch wirksamer bei der Behandlung von Infektionskrankheiten sind.
Unsere Forschung
Wenn eine Person mit einem Krankheitserreger infiziert wird, beginnen B-Zellen, enorme Mengen an Antikörpern mit einer einzigartigen Spezifität gegen den Erreger auszuschütten. Die variable Fab-Region des Antikörpermoleküls vermittelt die Antigenbindung und kann so das Eindringen in die entsprechende Wirtszelle „neutralisieren“.
Die Fähigkeit des Immunsystems, schnell und effektiv auf den eindringenden Erreger zu reagieren, hängt neben Neutralisation und Bindung auch von der Fähigkeit der Antikörper ab, weitere Immunmechanismen wie Phagozytose, Zytotoxizität und die Freisetzung von pro-/anti-inflammatorischen Mediatoren über Fc:Fc-Rezeptor-Interaktion auf angeborenen Immunzellen zu induzieren. Diese Fc-vermittelten Mechanismen hängen von einer Reihe von Faktoren ab, einschließlich der Expressionsmuster von aktivierenden und hemmenden Fc-Rezeptoren auf Effektorzellen, der Subklassen- und Isotypenverteilung sowie der Zugänglichkeit des Fc-Teils und posttranslationaler Fc-Modifikationen (z.B. Glykosylierung) der antigen-spezifischen Immunkomplexe.
Die translationalen Projekte in der Forschungsgruppe zielen darauf ab, unser Wissen über die Rolle der Antikörper-Effektorfunktionen bei Infektionskrankheiten zu erweitern, die zugrundeliegenden Mechanismen der Fc:Fc-Rezeptor-Interaktionen zu charakterisieren und neue Ansätze zur Verbesserung antikörperbasierter Therapien zu identifizieren.
Schützende antivirale Immunität – die Natur als Beispiel

Neue Daten deuten auf die entscheidende Rolle von spezifischen Antikörper-Effektorprofilen bei der Bekämpfung von Infektionskrankheiten hin. Dabei können bestimmte Merkmale, die für bestimmte Erreger schützend sind, in anderen Zusammenhängen wirkungslos oder sogar nachteilig sein. Für das Verständnis schützender Immunantworten wird es entscheidend sein, erregerspezifische Antikörper in humanen Kohorten zu untersuchen und genauestens zu charakterisieren. In diesem Projekt nutzen wir einen systematischen immunbiologischen Ansatz, um schützende Antikörperantworten in verschiedenen Gruppen und Modellen (z.B. nach Infektion oder Impfung) zu charakterisieren. Wir untersuchen eine Reihe von biophysikalischen Eigenschaften, wie zum Beispiel die Subklassen- und Isotypenverteilung, die Fc-Rezeptor-Bindung sowie angeborene Effektorfunktionen wie Phagozytose und Zytotoxizität, um spezifische Merkmale einer schützenden Immunität zu identifizieren.
Nutzung der Antikörper-Fc-Effektorfunktion als therapeutisches Target
Monoklonale Antikörper sind hochwirksame therapeutische Moleküle. Sie haben die Behandlung von Krebs und entzündlichen Erkrankungen revolutioniert. Auch bei Infektionskrankheiten gibt es zunehmend Erfolge, therapeutische Antikörper gegen Viren zu entwickeln und auf den Markt zu bringen. Die meisten, wenn nicht alle, anti-viralen monoklonalen Antikörper wurden aufgrund ihrer Fähigkeit, Pathogene zu neutralisieren und zu blockieren, ausgewählt.
In unserem aktuellen Forschungsprojekt wollen wir noch einen Schritt weitergehen und bestehende monoklonale Antikörpertherapien durch die Optimierung ihrer Fc-Effektorfunktionen verbessern. Indem wir die Bedeutung der Fc-Effektorfunktionen nutzen, wollen wir neuartige Therapieansätze aufzeigen, die noch wirksamer bei der Behandlung von Infektionskrankheiten sind.
Prof. Dr. Yannic Bartsch

Yannic Bartsch ist Leiter der Nachwuchsgruppe und W1-Professor für "Antivirale Antikörper-Omics" am TWINCORE, einer gemeinsamen Einrichtung des Helmholtz-Zentrums für Infektionsforschung (HZI) und der Medizinischen Hochschule Hannover (MHH). Seine primären Forschungsschwerpunkte sind die Analyse und das Verständnis der Rolle von Antikörper-vermittelten Effekten in (Infektions-) Erkrankungen mit dem Ziel, Antikörper therapeutisch zur Abschwächung von Infektionsverläufen zu nutzen. Dr. Bartsch promovierte an der Universität Lübeck, wo er die schützende Wirkung der IgG-Fc-Sialylierung in Mausmodellen von Autoimmunkrankheiten sowie einen Mechanismus zur Adjuvans-abhängigen Veränderung der IgG-Glykosylierung nach Impfung in Mäusen untersuchte. Als Postdoktorand am Ragon Institute of Mass General, MIT und Harvard in Cambridge (USA) untersuchte er in den Laboren von Prof. Galit Alter und Prof. Boris Julg die Rolle der Fc-Effektor-Funktionen von Antikörpern bei viralen Infektionen wie HIV und SARS-CoV-2. Des Weiteren zeigte er die entscheidende Rolle der Fc-vermittelten Antikörper-Effektorfunktion für den Schutz gegen das Respiratorische Synzytial-Virus (RSV) auf. Seine Forschungsarbeiten haben zu zahlreichen (Erst-)Autorenschaften in renommierten (peer-review) Fachzeitschriften geführt.

