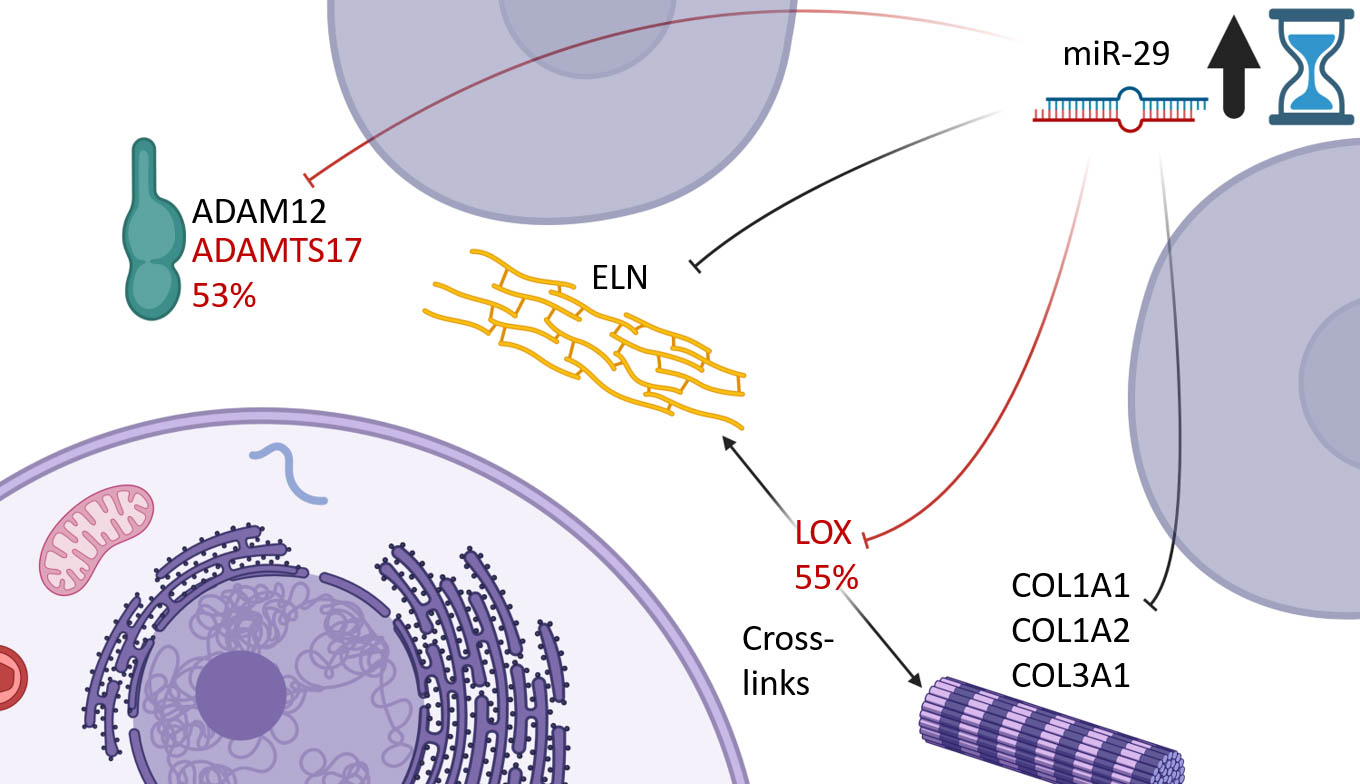
Wie und warum altern unsere Organe im Laufe der Jahre und Jahrzehnte? Auf der Suche nach den molekularen Hintergründen des Alterungsprozesses sind Saarbrücker Forscherinnen und Forscher gemeinsam mit Kolleginnen und Kollegen der Stanford University nun einen Schritt vorangekommen: Ein Team um den Saarbrücker Professor für Klinische Bioinformatik Andreas Keller untersuchte Organe von Mäusen vom jungen bis ins hohe Alter und fand heraus, dass die Menge von kleinen, nicht-kodierenden RNAs (sncRNAs) in den Organen je nach Alter der Mäuse deutliche Unterschiede aufweist: „Wir haben einige RNA-Moleküle identifiziert, die mit dem Alter häufiger vorkommen – sowie solche, deren Menge sich deutlich verringert“, sagt Prof. Andreas Keller, der auch als Leiter der Abteilung Klinische Bioinformatik am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) forscht. Das HIPS ist ein Standort des Helmholtz-Zentrums für Infektionsforschung (HZI) in Zusammenarbeit mit der Universität des Saarlandes.
Unter den sncRNAs gibt es einige Vertreter, die die Menge sogenannter Boten-RNA-Moleküle (messenger RNA, mRNA) spezifisch regulieren. Deren Aufgabe wiederum ist es, in jeder Zelle abschnittsweise Kopien von Teilen der gespeicherten genetischen Information, der DNA, bereitzustellen. Dieser Vorgang wird als Transkription bezeichnet. Somit trägt die mRNA den Bauplan für die Herstellung von einzelnen Proteinen, die wiederum alle Stoffwechselvorgänge im Körper steuern. „Vergleicht man die DNA mit einem Kochbuch, in dem sämtliche Rezepte enthalten sind, so kopiert sich die mRNA gleichsam einzelne Rezepte heraus, aus denen als Speisen die entsprechenden Proteine entstehen“, veranschaulicht die Biotechnologin und Erstautorin der Publikation Viktoria Wagner die untersuchten Prozesse. Werden mRNA-Moleküle nun durch andere RNAs blockiert, so wird der weitere Übersetzungsprozess unterbunden und in der Folge werden auch keine Eiweiße mehr produziert. „Die gehemmte Proteinproduktion beeinflusst den Stoffwechsel in Zellen und Organen und wirkt sich letztlich auch auf den Alterungsprozess des gesamten Organismus aus“, erläutert Wagner.
Die Saarbrücker Forscherinnen und Forscher beschreiben nun molekulare Alterungssignaturen und -muster, die entweder generell, das heißt über alle untersuchten Organe hinweg, oder aber spezifisch für einzelne Organe aufgetreten sind. „Ein spezielles Molekül hat dabei besonders starke Effekte in der Leber gezeigt“, sagt Keller, der mit seinem Saarbrücker Team die Sequenzierung sowie die Analyse der beträchtlichen Datenmengen mittels bioinformatischer Software durchgeführt hat. „Die Ergebnisse weiterer Experimente zeigten, dass es beim Alterungsprozess erstaunlicherweise sogar umkehrbare Mechanismen gibt, zumindest auf einem molekularen Level.“
In zukünftigen Forschungsarbeiten wollen die Bioinformatiker nun die RNA-Moleküle näher unter die Lupe nehmen, die als potenzielle Alterungsmarker für bestimmte Organe herangezogen werden sollen. „Mithilfe eines hieraus entwickelten Biomarkers ließe sich durch Analyse des Blutes der individuelle Alterungsprozess eines Menschen beobachten“, so Keller. Dies ist besonders interessant, da der Prozess der Alterung immer noch eine der Hauptursachen für weit verbreitete Krankheiten ist.
Perspektivisch eröffne dies noch deutlich weitergehende Möglichkeiten: „Wir wissen inzwischen, dass Infektionskrankheiten mitunter einen starken Stress für alle unsere Zellen bedeuten und damit deren Alterung sogar beschleunigen können“, sagt Dr. Fabian Kern, Nachwuchsgruppenleiter am HIPS. Der Bioinformatiker hat die in der Studie angewandten Softwaretools maßgeblich entwickelt und erläutert die Bedeutung der aktuellen Forschungsergebnisse: „Anhand neuester Technologien und Methoden des maschinellen Lernens können wir molekulare Signalwege exakt klassifizieren. Aus den gewonnenen Erkenntnissen wollen wir in einem nächsten Schritt neue Ansatzpunkte für innovative Medikamente ableiten und befinden uns damit bereits in einer Frühphase der Wirkstofffindung. Während klassische Wirkstoffe auf der Ebene von Proteinen eingreifen, würde dies eine gezielte Veränderung auf der Ebene der messenger-RNA bedeuten.“
Hintergrund:
Ihre Expertise im Bereich der Wirkstoffforschung wollen die Universität des Saarlandes (UdS) und das Saarbrücker Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) mit einer neuen Kooperationsplattform bündeln: Der PharmaScienceHub (PSH) soll die Wirkstoffforscher:innen der Universität und des HIPS noch besser miteinander vernetzen und insbesondere die Interaktion mit der Industrie stärken. „Ziel ist es, vielversprechende Ergebnisse aus der Grundlagenforschung – also aus dem Labor oder der Bioinformatik – gezielt in die industrielle Anwendung zu bringen (translationale Forschung). „Der PSH soll ein Inkubator für die Entwicklung neuer Medikamente sein“, sagt Informatik-Professor Andreas Keller. Neben dem „klassischen“ Thema der Infektionskrankheiten solle es dabei auch um Themen wie Krebsmedikamente und die Altersforschung gehen.
Originalpublikation:
Wagner V., Kern F., Hahn O., Schaum N., Ludwig N., Fehlmann T., Engel A., Henn D., Rishik S., Isakova A., Tan M., Sit R., Neff N., Hart M., Meese E., Quake S., Wyss-Coray T. & Keller A. (2023) Characterizing expression changes in noncoding RNAs during aging and heterochronic parabiosis across mouse tissues, Nature Biotechnology. DOI: 10.1038/s41587-023-01751-6