Die meisten herkömmlichen molekularbiologischen Diagnostikverfahren – insbesondere die derzeit in der Pandemiebekämpfung zum Einsatz kommenden PCR-Tests – weisen in der Regel nur einen einzelnen krankheitsbezogenen Biomarker nach, beispielsweise eine bestimmte Sequenz von SARS-CoV-2. Solche sogenannten Singleplex-Verfahren liefern sehr zuverlässige Ergebnisse, da sie auf ein einziges Testmerkmal geeicht sind. Um jedoch zu erkennen, ob ein Patient womöglich mit einer neuen Variante des Coronavirus oder eventuell mit einem ganz anderen Erreger infiziert ist, müssen viele verschiedene Faktoren überprüft werden.
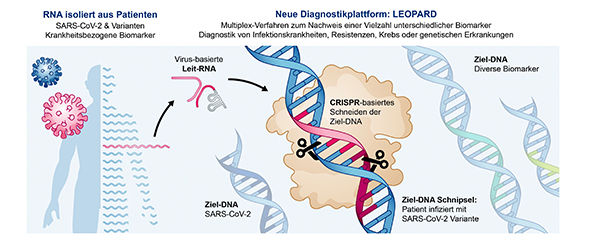
Wissenschaftler:innen vom Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI) und der Julius-Maximilians-Universität (JMU) in Würzburg haben jetzt mit LEOPARD den Weg für eine gänzlich neue Diagnostikplattform bereitet. Es handelt sich dabei um ein CRISPR-basiertes Verfahren, das multiplexfähig ist: Es kann potenziell eine Vielzahl an krankheitsbezogenen Biomarkern in nur einem Test nachweisen.
So funktioniert LEOPARD
LEOPARD (Leveraging Engineered tracrRNAs and On-target DNAs for PArallel RNA Detection) beruht auf der in der Studie gewonnenen Erkenntnis, dass bestimmte Ribonukleinsäuren (RNAs, von Engl. ribonucleic acids) so programmierbar sind, dass die CRISPR-Technologie zum gezielten Nachweis von zellulären RNAs eingesetzt werden kann. Dadurch können beispielsweise RNAs von Viren oder anderen Krankheitserregern in einer Patientenprobe nachgewiesen werden.
Chase Beisel, Professor an der JMU und Forschungsgruppenleiter am HIRI, der die heute im Magazin Science veröffentlichte Studie gemeinsam mit Prof. Cynthia Sharma vom Institut für Molekulare Infektionsbiologie (IMIB) der JMU initiiert hat, zeigt sich erfreut: „Mit LEOPARD ist es uns gelungen, RNA-Fragmente von neun verschiedenen Viren nachzuweisen. Wir konnten außerdem SARS-CoV-2 und eine Variante in einer Patientenprobe differenzieren und zugleich bestätigen, dass die Probe korrekt erfasst wurde.“
Hintergrund
CRISPR-Technologien sind molekularbiologische Werkzeuge, die unter anderem der Genombearbeitung dienen. Häufig als Genschere bezeichnet, besteht CRISPR-Cas9 aus einer Protein- und einer RNA-Komponente, die es ermöglichen, bestimmte Genomabschnitte von Tieren, Pflanzen und Mikroorganismen gezielt zu verändern. In der Natur kommt die Genschere Cas9 in Bakterien wie dem Lebensmittelkeim Campylobacter vor und schützt diese beispielsweise vor eindringenden Viren. Für diesen Prozess der Immunabwehr wird eine CRISPR-RNA (crRNA), also gewissermaßen eine „Leit-RNA“, benötigt. Sie hilft dabei, ausgewählte Regionen des fremden Genoms exakt anzusteuern und unschädlich zu machen: Die von einer crRNA geleitete Nuklease Cas9 kann ihr Ziel dann wie eine Schere zerschneiden.
Unerwartete Entdeckung
LEOPARD basiert auf einer Entdeckung in der Grundlagenforschung zur RNA-Biologie von Mikroorganismen. Bei ihren Experimenten bemerkten die Würzburger Wissenschaftler:innen, dass die für die Funktionalität der Genschere erforderliche crRNA nicht nur mit der Immunabwehr zusammenhängt. Cynthia Sharma, Leiterin des Lehrstuhls für Molekulare Infektionsbiologie II am IMIB und Sprecherin des Zentrums für Infektionsforschung (ZINF) der JMU: „Als wir im Labor in unserem Modellorganismus Campylobacter nach RNA-Molekülen gesucht haben, die von Cas9 gebunden werden, waren wir sehr überrascht, dass wir nicht nur die crRNAs des bakteriellen Immunsystems detektieren konnten, sondern auch andere zelluläre RNA-Fragmente, die wie crRNAs aussahen. Diese neuartigen crRNAs waren offenbar von anderen Transkripten in der Zelle wie beispielsweise Boten-RNAs abgeleitet.“
Die Diagnostikplattform LEOPARD baut auf dieser Entdeckung auf. Relevant für LEOPARD sind sogenannte tracrRNAs. Diese werden für die Generierung der Leit-RNAs sowie die Funktion der Genschere Cas9 benötigt. Chase Beisel: „Wir haben herausgefunden, wie wir die tracrRNAs so umprogrammieren können, dass wir dadurch entscheiden, welche RNA eine Leit-RNA wird, um damit die Cas9-Nuklease zu steuern. Anschließend konnten wir überprüfen, welche Genomsequenzen damit geschnitten werden und auf welches Pathogen, also auf welchen Krankheitserreger, dies zurückzuführen ist. Da diverse Möglichkeiten parallel in nur einem Test durchgespielt werden können, ist diese Technologie sehr schnell und effizient.“
Die Leistungsfähigkeit von LEOPARD könnte künftig selbst multiplexfähige PCR-Tests und andere Methoden in den Schatten stellen. „Die Technologie hat das Potenzial, die medizinische Diagnostik nicht nur von Infektionskrankheiten und Resistenzen, sondern auch von Krebs und seltenen genetischen Erkrankungen zu revolutionieren“, sagt Prof. Oliver Kurzai, Vorstand des Instituts für Hygiene und Mikrobiologie der JMU, das Patientenproben für die Studie bereitgestellt hat.
Bund und Freistaat fördern LEOPARD
„Die fachübergreifende Zusammenarbeit ist ein Erfolgsbeispiel für den hiesigen Wissenschaftsstandort“, meint Prof. Jörg Vogel, Direktor des IMIB und des HIRI. „LEOPARD demonstriert eindrucksvoll, dass wir in Würzburg von den Grundlagen der RNA-Forschung über den Kliniksektor bis zur medizinischen Anwendung das volle Spektrum komplementärer Spitzenforschung abbilden können“, sagt Vogel.
Die aktuelle Studie wurde unter anderem aus Mitteln der Deutschen Forschungsgemeinschaft (DFG SPP 2141) gefördert. Für eine spätere Markteinführung von LEOPARD konnten außerdem Fördergelder („GO-BIO initial“) des Bundesministeriums für Bildung und Forschung und der Medical Valley Award des Bayerischen Staatsministeriums für Wirtschaft, Landesentwicklung und Energie eingeworben werden.
Originalpublikation
Chunlei Jiao, Sahil Sharma†, Gaurav Dugar†, Natalia L. Peeck, Thorsten Bischler, Franziska Wimmer, Yanying Yu, Lars Barquist, Christoph Schoen, Oliver Kurzai, Cynthia M. Sharma*, Chase L. Beisel*. Non-canonical crRNAs derived from host transcripts enable multiplexable RNA detection by Cas9. Science, April 2021. DOI: 10.1126/science.abe7106